题目内容
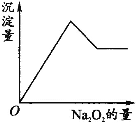
【题目】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示。
试推断:
(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验方法为________。
【答案】Al3+和Mg2+ Fe3+、NH4+、Cu2+ K+ 焰色反应
【解析】
根据离子共存的条件和离子检验方法分析。
(1) 加入Na2O2粉末后,Na2O2与水反应生成NaOH和O2,只有无色无味的气体放出,说明只有O2放出,故一定不含有NH4+,析出白色沉淀,说明一定没有Fe3+和Cu2+,有可能含有Al3+和Mg2+,从图像中可知,沉淀量变化有生成也有溶解,说明一定含有Al3+和Mg2+; (2)一定不含有Fe3+、NH4+、Cu2+;
(3)从已知条件中,未获得信息可以证明K+是否存在,故K+可能存在;
(4)为了验证K+是否存在,可以用焰色反应,透过蓝色故玻璃观察是否有蓝色出现;

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
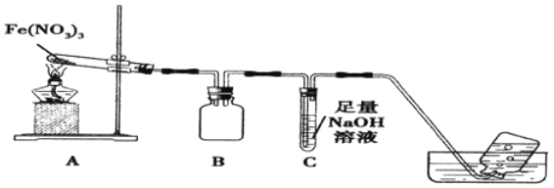
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
【题目】人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(3)装置E的作用是____________________。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
② I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________(填仪器名称)盛装,该废水中Ba2+的物质的量浓度为_______________________span>。