题目内容
【题目】下列有关说法中,不正确的是( )
A. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该反应的速率.
B. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C. 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
【答案】B
【解析】A. 因催化剂可降低反应的活化能,使反应速率加快,故A正确;B. FeCl3和MnO2均可做H2O2分解的催化剂加快H2O2分解,同等条件下二者对H2O2分解催化效果不相同,则反应速率的改变不同,故B错误;C. NaHSO4溶于水完全电离为钠离子、氢离子和硫酸根离子,溶液显酸性,水的电离被抑制,溶液中的氢氧根离子全部来自于水的电离,溶液的pH=4,氢离子浓度c(H+)=104mol/L,则c(OH)=1010mol/L,因水电离出的氢离子和水电离出的氢氧根离子的浓度相同,所以溶液中水电离出的H+浓度为1×1010mol/L,故C正确;D. Mg(OH)2固体在溶液中存在溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),NH4Cl溶液中NH4+水解使溶液呈酸性,会消耗Mg(OH)2溶解平衡中的OH-,使Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),NH4Cl溶液中NH4+水解使溶液呈酸性,会消耗Mg(OH)2溶解平衡中的OH-,使Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)平衡正向移动,即Mg(OH)2固体可溶于NH4Cl溶液,故D正确;答案选B。
Mg2+(aq)+2OH-(aq)平衡正向移动,即Mg(OH)2固体可溶于NH4Cl溶液,故D正确;答案选B。

【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
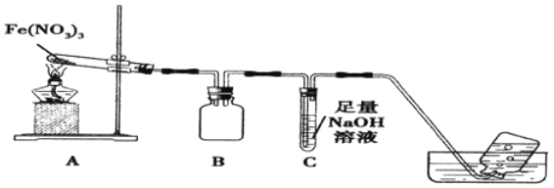
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
