题目内容
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )

A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
【答案】A
【解析】
A.放电时电子由负极流向正极,镁是负极,多孔活性碳材料是正极,即放电时外电路电子由镁电极流向多孔碳材料电极,故A错误;
B.放电时,正极氧气发生还原反应生成氢氧根离子,所以正极的电极反应式为O2+4e-+2H2O=4OH-,故B正确;
C.理论上,外电路中流过2mol电子时,生成1mol的镁离子,结合2mol的氢氧根离子,所以负极质量增加34g,故C正确;
D.氢氧化镁受热分解产生氧化镁,氧化镁还原成单质镁循环利用,故D正确;
答案为A。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
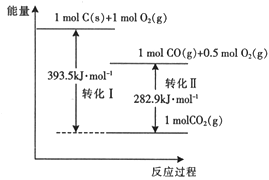
99加1领先期末特训卷系列答案【题目】对于反应A(g)![]() 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。

(1)根据曲线图,下列说法不正确的是___。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
上表中n3___n4(填“大于”、“小于”或“等于”),反应A(g)![]() 2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)![]() A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。