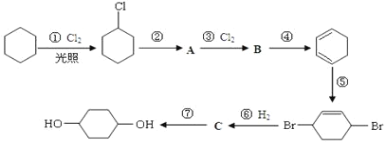
题目内容
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
【答案】去除蒸馏水中的氧气,防止亚硫酸钠被氧化 500mL容量瓶 烧杯、玻璃棒 SO32-+2Ag+=Ag2SO3↓ Na2SO3被酸化的NO3-氧化成Na2SO4,Na2SO4与AgNO3溶液反应生成Ag2SO4沉淀 取固体少许加入足量Na2SO3溶液(或向试管中继续滴加Na2SO3溶液) Ag2O+4NH3·H2O=2Ag(NH3)2OH+3H2O或Ag2O+4NH3+H2O=2Ag(NH3)2OH AgOH Na2SO3溶液滴加顺序不同(或用量不同),溶液酸碱性不同(或浓度不同)
【解析】
配置一定物质的量浓度的溶液时,①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸;②移液时:配置一定物质的量浓度的溶液时需要使用容量瓶,移液时需要洗涤烧杯和玻璃棒;
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
①假设一是银离子与亚硫酸根离子反应生成亚硫酸银;
②考虑加入的酸性的硝酸银溶液具有氧化性,将亚硫酸银氧化成硫酸银;
③由于Ag2SO3溶于过量Na2SO3溶液,可以加入Na2SO3溶液验证溶液中是否有Ag2SO3;
Ⅰ.(1)配制500mL一定浓度的Na2SO3溶液
①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸,防止亚硫酸钠被氧化;
②移液时:配置一定物质的量浓度的溶液时需要使用500ml的容量瓶,移液时需要洗涤烧杯和玻璃棒2~3次;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
①假设一是银离子与亚硫酸根离子反应生成亚硫酸银SO32-+2Ag+= Ag2SO3↓;
②将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,酸性溶液中存在氢离子,氢离子和硝酸根相当于硝酸,具有氧化性,可能会将亚硫酸根离子氧化成硫酸根;
③.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液,故可以取固体少许加入足量Na2SO3溶液(或向试管中继续滴加Na2SO3溶液),看是否继续溶解,若继续溶解一部分,说明假设三成立;
(3)①Ag2O,棕黑色固体,不溶于水,可与浓氨水反应,反应a为Ag2O + 4NH3·H2O =2Ag(NH3)2OH + 3H2O;
②将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,由于亚硫酸银易溶于亚硫酸钠,故生成的白色沉淀不是亚硫酸银,溶液呈碱性,也不是硫酸银,银离子在碱性条件下,例如银离子和氨水反应可以生成氢氧化银,是白色沉淀,A为AgOH;
(4)实验(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,实验(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,对比两次实验可以看出,滴加顺序不同(或用量不同),所给盐溶液酸碱性不同(或浓度不同)。

【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q