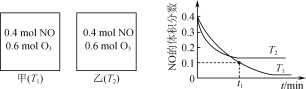
题目内容
【题目】下列指定反应的离子方程式正确的是( )
A.Na与水反应:Na+2H2O=Na++2OH-+H2↑
B.用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O
C.用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
【答案】C
【解析】
A.离子方程式要符合质量守恒,Na与水反应生成NaOH和H2:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.NaNO2和NaNO3均为强电解质,用NaOH溶液吸收NO2生成NaNO2和NaNO3:2NO2+2OH-=NO3-+NO2-+H2O,故B错误;
C.用MnO2和浓盐酸反应制备Cl2,同时生成氯化锰和水:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故C正确;
Mn2++Cl2↑+2H2O,故C正确;
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O,故D错误;
故选C。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
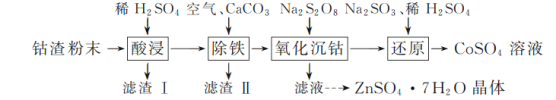
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
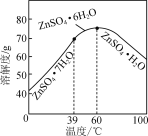
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)