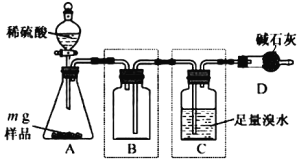
题目内容
【题目】往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法不正确的是
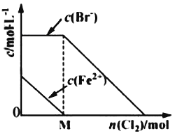
A.当n(Cl2)<M mol时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl―
B.当n(Cl2)=M mol时,离子浓度关系:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D.当Br―开始被氧化时,通入Cl2的物质的量小于原FeBr2的物质的量
【答案】B
【解析】
根据图像可知,将氯气通入溴化亚铁时,第一步发生的反应为Cl2+2Fe2+=2Cl-+2Fe3+,第二步发生的反应为Cl2+2Br-=2Cl-+Br2。
A. 当n(Cl2)<M mol时,发生的是分析中的第一步反应,即Cl2+2Fe2+=2Cl-+2Fe3+,故A正确;
B. 当通入的氯气为M mol恰好将![]() 反应完时,
反应完时,![]() 有2M mol,Cl-有2M mol,
有2M mol,Cl-有2M mol,![]() 有4M mol,所以
有4M mol,所以![]() :
:![]() :
:![]() =1:2:1,故B错误;
=1:2:1,故B错误;
C. 当通入的氯气为2M mol,Mmol氯气首先与![]() 完全反应,生成2Mmol
完全反应,生成2Mmol![]() ,剩余的Mmol氯气会反应掉2Mmol
,剩余的Mmol氯气会反应掉2Mmol![]() ,生成2Mmol
,生成2Mmol![]() ,此时
,此时![]() ,
,![]() ,所以离子浓度大小关系:c(Cl-)>c(Br-),故C正确;
,所以离子浓度大小关系:c(Cl-)>c(Br-),故C正确;
D. 当Br―开始被氧化时,通入Cl2的物质的量为Mmol,而原FeBr2的物质的量为2Mmol,故D正确;
故答案选B。

练习册系列答案
相关题目