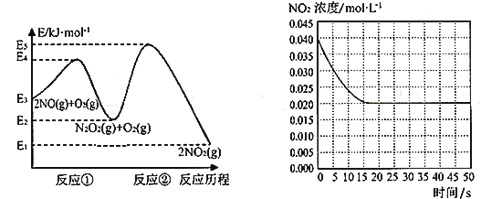
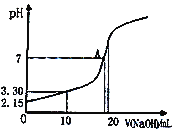
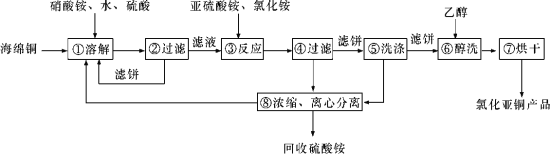
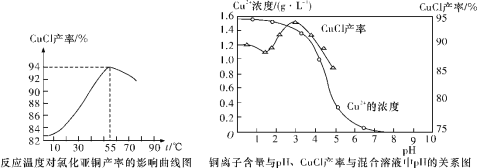
题目内容
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2) :c(H2) :c(HCl)=1:3:6
【答案】C
【解析】
A.由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,当3v逆(N2)=v正(H2)时,能表示反应达到化学平衡状态,故A不符合题意;
Si3N4(s)+12HCl(g)可知,当3v逆(N2)=v正(H2)时,能表示反应达到化学平衡状态,故A不符合题意;
B. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知, 4v正(HCl)=v正(SiCl4) ,能表示反应达到化学平衡状态,故B 不符合题意;
Si3N4(s)+12HCl(g)可知, 4v正(HCl)=v正(SiCl4) ,能表示反应达到化学平衡状态,故B 不符合题意;
C. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,化学反应前后气体质量不等,容器的体积不变,所以混合气体密度保持不变,能表示反应达到化学平衡状态,故C 符合题意;
Si3N4(s)+12HCl(g)可知,化学反应前后气体质量不等,容器的体积不变,所以混合气体密度保持不变,能表示反应达到化学平衡状态,故C 符合题意;
D. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,浓度的变化量之比等于化学反应计量数之比,即c(N2) :c(H2) :c(HCl)=1:3:6,不能说明反应达到平衡状态,故D不符合题意;
Si3N4(s)+12HCl(g)可知,浓度的变化量之比等于化学反应计量数之比,即c(N2) :c(H2) :c(HCl)=1:3:6,不能说明反应达到平衡状态,故D不符合题意;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
(1)根据上述数据,可计算出该盐酸的浓度约为_______________(保留四位有效数字)。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(3)氧化还原滴定实验同中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色H2C2O4溶液。反应离子方程式是_________________________________,滴定达到终点的标志是___________________________________________________。