题目内容
19.1mol乙烷与3molCl2在光照条件下反应,理论上得到的氯代物有( )| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |
分析 依据题意找出各种不同环境化学的H原子,有几种H就有几种一氯取代物,然后找出等效H判断四氯代物与五氯代物.
解答 解:乙烷中有1种H,故只有一种,乙烷中2个H被取代,可以是相同碳上的H和不同碳上的H,有2种,三氯乙烷可以是同一碳上H或不同碳上的H,有2种,四氯乙烷相当于六氯乙烷中的氯原子被2个H取代,所以与二氯乙烷相同,有2种,同理五氯乙烷有1种,六氯乙烷1种,故总共可以生成氯代物为1+2+2+2+1+1=9,
故选D.
点评 本题主要考查的是烷烃的性质-取代反应,掌握取代反应原理是解决本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列关于燃料电池的说法正确的是( )
| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
19. 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子杂化轨道类型为sp杂化.
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是氨分子之间能形成氢键;PH3的分解温度高于其沸点,其原因是PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多.
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”“<”或“=”)109°28°;PO43-离子的空间构型为正四面体.
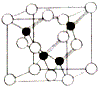
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:经过计算,该晶体的化学式是AlP.
 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”“<”或“=”)109°28°;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:经过计算,该晶体的化学式是AlP.
7.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是( )
| A. | SiO2 | B. | CO2 | C. | NaCl | D. | Ar |
14.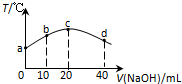 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
8.有A、B、C、D、E五种短周期元素,其元素特征信息如表:
回答下列问题:
(1)写出下列元素的名称:A氢、B氧、C钠、D铝、E氯;
(2)写出A、B、C形成的化合物M的化学式NaOH;
(3)写出A、B、C形成的化合物M的电子式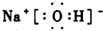 .
.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:A氢、B氧、C钠、D铝、E氯;
(2)写出A、B、C形成的化合物M的化学式NaOH;
(3)写出A、B、C形成的化合物M的电子式
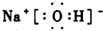 .
.
9.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 18.8g苯酚中含有碳碳双键的个数为0.6NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 标准状况下,11.2L 三氯甲烷所含分子数为0.5NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
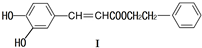 在药物、涂料等领域应用广泛.
在药物、涂料等领域应用广泛.
 ;反应类型:水解(取代)反应
;反应类型:水解(取代)反应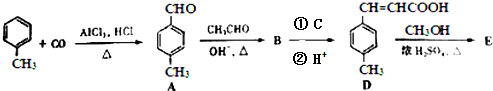
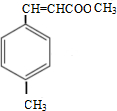 .
.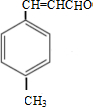 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$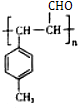 .
. 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断