题目内容
18.下列关于燃料电池的说法正确的是( )| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
分析 A.燃料电池中燃料不燃烧;
B.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极;
C.氢氧燃料电池反应实际上就相当于氢气的燃烧反应,生成水;
D.燃料电池放电过程中,不仅化学能转化为电能,化学能还转化为热能.
解答 解:A.燃料电池中燃料不燃烧,是直接将化学能转化为电能,故A错误;
B.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,所以氢氧燃料电池中通入氢气的电极是负极、通入氧气的电极是正极,故B错误;
C.氢氧燃料电池反应实际上就相当于氢气的燃烧反应,生成水,不污染环境,所以属于环境友好电池,故C正确;
D.燃料电池放电过程中,不仅化学能转化为电能,化学能还转化为热能等,所以燃料电池的能量转化率不可达100%,故D错误;
故选C.
点评 本题考查化学电源新型电池,侧重考查原电池原理,知道燃料电池中正负极通入气体成分及发生的反应,知道燃料电池的本质,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
8.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. | 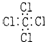 | D. | 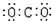 |
9.某化工厂冶炼金属、回收硫的工艺流程如下:
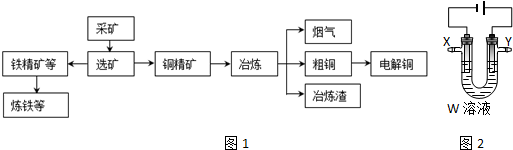
I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
铜盐溶液中Fe2+,Zn2+对精炼铜可能会产生影响.工业上,除去Fe2+方法是氧化沉淀法,在酸性混合溶液中加入双氧水(选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.加入碱调节溶液pH范围为3.7<pH<4.6.
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.

I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.
6.将2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+xD(g),2min后达到平衡时,A的转化率为50%,测得v(D)=0.25mol/(L•min).下列推断正确的是( )
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
13.常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是( )
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
3.下列有关元素锶(38Sr,ⅡA族)的叙述最不可能的是( )
| A. | 其氯化物是离子化合物 | B. | 其最高价氧化物水化物为一种弱碱 | ||
| C. | 它比Ca更易置换水中的氢 | D. | 它的碳酸盐难溶于水 |
10.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标志是:(分别用V表示正反应速率,V╯表示逆反应速率)( )
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
7.短周期主要素X、Y、Z、W,在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
19.1mol乙烷与3molCl2在光照条件下反应,理论上得到的氯代物有( )
| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |