题目内容
8.有A、B、C、D、E五种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:A氢、B氧、C钠、D铝、E氯;
(2)写出A、B、C形成的化合物M的化学式NaOH;
(3)写出A、B、C形成的化合物M的电子式
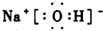 .
.
分析 A的单质是密度最小的物质,则AH元素;B的阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为O元素;C的阳离子与B的阴离子有相同的电子层结构,氧离子含有两个电子层,则C处于第三周期的金属元素,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,与C同周期,则D为Al元素;E与C同周期,原子半径在该周期最小,则E处于第三周期,为Cl元素,据此进行解答.
解答 解:(1)A的单质是密度最小的物质,则A为H元素;B的阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为O元素;C的阳离子与B的阴离子有相同的电子层结构,氧离子含有两个电子层,则C处于第三周期的金属元素,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,与C同周期,则D为Al元素;E与C同周期,原子半径在该周期最小,则E处于第三周期,为Cl元素,
根据分析可知,A为氢元素、B为氧、C为钠、D为铝、E为氯元素,
故答案为:氢;氧;钠;铝;氯;
(2)A为氢元素、B为氧元素、C为钠元素,A、B、C形成的化合物M为氢氧化钠,氢氧化钠的化学式为:NaOH,
故答案为:NaOH;
(3)氢氧化钠为离子化合物,其电子式为: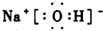 ,
,
故答案为: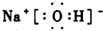 .
.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素为解答关键,注意掌握元素周期表结构、元素周期律内容,试题充分考查了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.短周期主要素X、Y、Z、W,在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
19.1mol乙烷与3molCl2在光照条件下反应,理论上得到的氯代物有( )
| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |
16.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
| A. | 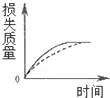 | B. |  | C. | 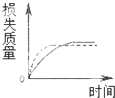 | D. | 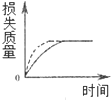 |
13.1mol某烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成四种不同的一氯取代物.该烃的结构简式是( )
| A. | 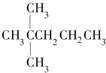 | B. | CH3CH2CH2CH2CH3 | C. | 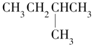 | D. | 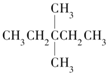 |
20.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
17.现有部分短周期元素的性质或原子结构如表:
(1)用化学用语回答下列问题:B元素在周期表中的位置第三周期第IA族;用电子式表示BD化合物的形成过程 .
.
(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是ac(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经如下变化的过程转化(反应条件和个别生成物已略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为1:1.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是ac(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经如下变化的过程转化(反应条件和个别生成物已略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为1:1.
18.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | B. | 水加热到1500℃开始分解 | ||
| C. | 熔融的氯化钠 | D. | NaOH溶于水 |
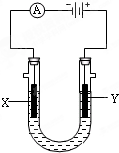 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.