题目内容
4.不饱和酯类化合物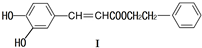 在药物、涂料等领域应用广泛.
在药物、涂料等领域应用广泛.(1)下列关于化合物Ⅰ的说法,正确的是CD
A.可能发生酯化反应和银镜反应
B.1mol化合物Ⅰ最多与2molNaOH反应
C.与FeCl3溶液能显紫色
D.能与溴发生取代和加成反应
(2)下面反应是一种由烯烃直接制备不饱和酯的新方法

①化合物Ⅱ的分子式为C9H10.
②1mol化合物Ⅱ能与4molH2恰好反应生成饱和烃类化合物.
③化合物Ⅲ与足量的NaOH溶液共热的化学方程式为
 ;反应类型:水解(取代)反应
;反应类型:水解(取代)反应(3)3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
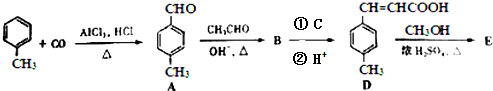
已知:HCHO+CH3CHO $\stackrel{OH-,△}{→}$ CH2=CHCHO+H2O
A中官能团的名称为醛基.D中含氧官能团的名称为羧基.
②E的结构简式为
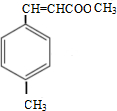 .
.③试剂C可选用下列中的b、d
a、溴水 b、银氨溶液 c、酸性KMnO4溶液 d、新制Cu(OH)2悬浊液
④B在一定条件下可以生成高聚物F,该反应的化学方程式为n
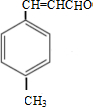 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$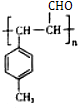 .
.
分析 (1)A.羟基或羧基能发生酯化反应,醛基能发生银镜反应;
B.能和NaOH反应的为酚羟基、羧基;
C.酚能和氯化铁溶液发生显色反应;
D.酚能和溴发生取代反应、碳碳双键能和溴发生加成反应;
(2)Ⅱ中含有9个C原子、10个H原子,据此确定化学式;能和氢气发生加成反应的有苯环和碳碳双键;化合物Ⅲ中有酯基,与足量的NaOH溶液共热时,发生酯的水解反应;
(3)由合成路线可知,甲苯发生取代反应生成A对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为 ,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D
,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D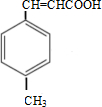 ,D与甲醇发生酯化反应生成E为
,D与甲醇发生酯化反应生成E为 ,然后结合有机物的结构与性质来解答;
,然后结合有机物的结构与性质来解答;
解答 解:(1)A.羟基或羧基能发生酯化反应,醛基能发生银镜反应,该物质不含醛基,所以不能发生银镜反应,故错误;
B.能和NaOH反应的为酚羟基、羧基,1mol化合物I最多能与3mol NaOH反应,故错误;
C.酚能和氯化铁溶液发生显色反应,该物质中含有酚羟基,所以能和氯化铁发生显色反应,故正确;
D.酚能和溴发生取代反应、碳碳双键能和溴发生加成反应,该物质中含有酚羟基和碳碳双键,所以能发生取代反应和加成反应,故正确;
故选CD;
(2)Ⅱ中含有9个C原子、10个H原子,其化学式为C9H10;能和氢气发生加成反应的有苯环和碳碳双键,1mol化合物Ⅱ能与4mol H2恰好完全反应生成饱和烃类化合物,化合物Ⅲ中有酯基,与足量的NaOH溶液共热时,发生酯的水解反应,反应方程式为 ,该反应为水解(取代)反应,
,该反应为水解(取代)反应,
故答案为:C9H10;4; ;水解(取代)反应;
;水解(取代)反应;
(3)由合成路线可知,甲苯发生取代反应生成对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为 ,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D
,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D ,D与甲醇发生酯化反应生成E为
,D与甲醇发生酯化反应生成E为 ,
,
根据A的结构简式可知,A中含有的官能团为醛基,D中含氧官能团的名称为羧基,
故答案为:醛基;羧基;
②E的结构简式为 ,
,
故答案为: ;
;
③试剂C不能与C=C反应,只氧化-CHO,则C为b或d,故答案为:b、d;
④B为 ,B中含C=C,在一定条件下可以生成高聚物F,发生加聚反应,则F的结构简式为
,B中含C=C,在一定条件下可以生成高聚物F,发生加聚反应,则F的结构简式为 ,反应方程式为n
,反应方程式为n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,
,
故答案为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
.
点评 本题考查了有机物的官能团及其性质,知道常见有机物官能团及其性质是解本题关键,知道有机反应中断键、成键方式,并结合题给信息分析解答,题目难度中等.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 其氯化物是离子化合物 | B. | 其最高价氧化物水化物为一种弱碱 | ||
| C. | 它比Ca更易置换水中的氢 | D. | 它的碳酸盐难溶于水 |
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
| A. | 甲快 | B. | 乙快 | C. | 相等 | D. | 无法确定 |
| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 | Ⅱ | |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 | Ⅱ |
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.
| A. |  | B. |  | C. |  | D. |  |
| A. | 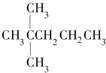 | B. | CH3CH2CH2CH2CH3 | C. | 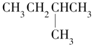 | D. | 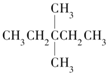 |
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H
△H=△H2-△H1-2△H3.这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
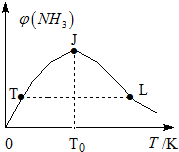
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是,JL段变化的主要原因是.氨气正反应速率:T点小于 L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×107}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$
=32.2kW•h•kg-1(列式计算).