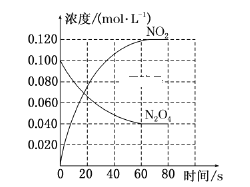
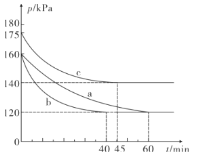
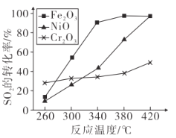
题目内容
【题目】将10.7g 氯化铵固体与足量氢氧化钙固体混合加热,使之充分反应。请计算:
(1)生成的氨气在标准状况下的体积是多少升____?
(2)若将这些氨气配成500mL氨水,该氨水的物质的量浓度是多少____________?
【答案】4.48 L 0.4 mol/L
【解析】
氯化铵固体与足量氢氧化钙固体混合加热,反应方程式为:2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+ CaCl2,10.7g (即0.2mol)氯化铵固体参与反应,根据方程式进行计算。
2NH3↑+2H2O+ CaCl2,10.7g (即0.2mol)氯化铵固体参与反应,根据方程式进行计算。
(1)10.7g (即0.2mol)氯化铵固体参与反应,生成氨气的物质的量为0.2mol,标况下的体积为0.2mol×22.4L/mol=4.48L;
(2)4.48L氨气溶于水配成500mL溶液,溶液的浓度c=![]() =
=![]() =0.4 mol/L。
=0.4 mol/L。

【题目】苯甲酸(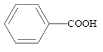 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(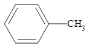 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
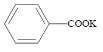 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
实验装置(部分夹持装置已略去)和流程如下:
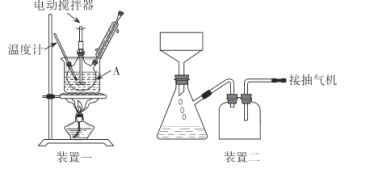
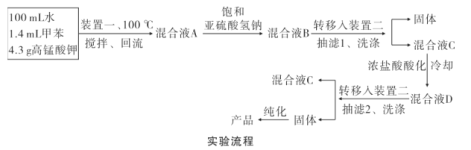
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。