题目内容
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
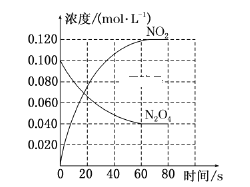
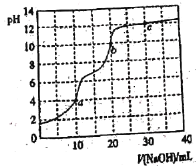
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
【答案】大于 0.001 0 mol·L-1·s-1 大于 正反应方向吸热,平衡向吸热方向移动,故温度升高 减小 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
【解析】
(1)根据温度对平衡状态的影响分析;根据υ=△c/△t计算;
(2)根据外界条件对平衡状态的影响分析。
(1)根据信息,升高温度,混合气体的颜色变深,说明平衡向正反应方向进行,根据勒夏特列原理,正反应方向为吸热反应,即△H>0;反应速率等于变化浓度和时间的比值,υ(N2O4)=(0.1-0.04)mol/L÷60 s=0.0010 mol/(L·s);
(2)①改变温度,c(N2O4)降低,说明平衡向正反应方向进行。由于正反应是吸热反应,根据勒夏特列原理,应是升高温度,即T>100℃;
②恒容状态下,再充入NO2,相当于在原来的基础上加压,平衡应向体积减小的方向移动,平衡向逆反应方向移动,因此新平衡建立后,NO2的体积分数减小;
(3)容积减少一半,压强增大,根据勒夏特列原理,增大压强,平衡向体积减小方向进行,即向逆反应方向移动。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱