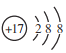题目内容
【题目】以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式________________。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_____________(写出两条)。
(2) “浸渣”中除含有某种有磁性的物质外,还含有的物质是_____(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是__________。然后再调节溶液的pH约为5,目的是______________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程_____________、 _________________。
【答案】Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度 Fe3O4 SiO2和CaSO4 将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物而除去 (七水)硫酸镁 2H3BO3
2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度 Fe3O4 SiO2和CaSO4 将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物而除去 (七水)硫酸镁 2H3BO3 ![]() B2O3+3HO B2O3+3Mg
B2O3+3HO B2O3+3Mg ![]() 3MgO+2B
3MgO+2B
【解析】
(1)Mg2B2O5·H2O与硫酸反应,生成硫酸镁和硼酸,根据质量守恒配平方程式如下:Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3;提高反应温度、减小铁硼矿粉径、搅拌等都可提高反应速率,以提高浸出速率。
2MgSO4+2H3BO3;提高反应温度、减小铁硼矿粉径、搅拌等都可提高反应速率,以提高浸出速率。
(2)Fe3O4有磁性,可将其从“浸渣”中分离;SiO2不溶于硫酸,CaO与硫酸反应生成的CaSO4是微溶物,两者都会留于滤渣中。
(3)pH约为5的溶液中,Fe3+能够沉淀完全,但Fe2+未沉淀,故需要加入强氧化剂H2O2溶液将Fe2+氧化为Fe3+,通过调节pH再将其除去;调节pH约为5的目的是使Fe3+和Al3+形成氢氧化物沉淀,然后过滤除去。
(4)冷却结晶过程中,硫酸镁也会结晶析出,因此“粗硼酸”中含有杂质(七水)硫酸镁。
(5)类比镁与二氧化碳的反应,镁可以与B2O3反应:2H3BO3 ![]() B2O3+3HO;要制得B2O3,可以直接将硼酸加热: B2O3+3Mg
B2O3+3HO;要制得B2O3,可以直接将硼酸加热: B2O3+3Mg ![]() 3MgO+2B。
3MgO+2B。