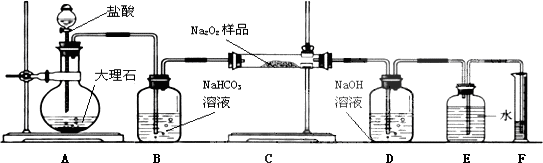
题目内容
6.铜及其化合物在工农业生产中都有着广泛应用.(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2.当有1molCu生成,则第一个反应中转移电子3mol.
(2)某种处理火法炼铜中SO2废气的工艺流程如图所示.

①溶液A中发生的反应离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为O2>Fe3+>SO42-.
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O.则
①反应中的x=8.
②反应产物R的化学式为NO.
分析 (1)2CuFeS2+O2=Cu2S+2FeS+SO2中,生成1molCu2S转移6mol电子,由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu;
(2)由工艺流程可知,A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反应为4Fe2++O2+4H+=4Fe3++2H2O,C中铁离子循环利用,结合氧化还原反应中氧化剂的氧化性大于氧化产物的氧化物分析;
(3)①由电荷守恒计算x;
②由电子守恒计算R中N元素的化合价,从而判断R.
解答 解:(1)反应2CuFeS2+O2=Cu2S+2FeS+SO2中,化合价变化情况为:Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则每生成1molCu2S转移电子6mol;由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu,所以当第二个反应生成1molCu时,第一个反应转移电子3mol,
故答案为:3;
(2)由工艺流程可知,A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反应为4Fe2++O2+4H+=4Fe3++2H2O,C中铁离子循环利用,
①由上述分析可知溶液A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②A中发生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,溶液B中发生4Fe2++O2+4H+=4Fe3++2H2O,由氧化剂的氧化性大于氧化产物的氧化性可知氧化性为O2>Fe3+>SO42-,
故答案为:O2>Fe3+>SO42-;
(3)①由电荷守恒可得:(-2)+x=2×3,则x=8,故答案为:8;
②设R中氮元素的化合价为a,由得失电子守恒可得:2×(5-a)=2×3,解得a=+2,则R为NO,故答案为:NO.
点评 本题以铜及其化合物为载体考查氧化还原反应的计算,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析、计算能力的综合考查,题目难度不大.

| A. | 分子总数 | B. | 总质量 | C. | 原子总数 | D. | 密度 |
| A. | 标准状况下,1.12 LH2和O2的混合气体含有的原子数为 0.1NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数为 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4 L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
| A. | 在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1L1 mol/L Na2CO3溶液中含阴离子数目小于0.1mol |
| A. | 盐 胆矾 KAl(SO4)2•12H2O | B. | 碱 纯碱 Na2CO3 | ||
| C. | 金属氧化物 氧化铜 CuO | D. | 无机化合物 醋酸 CH3COOH |
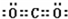 ;V原子的结构示意图
;V原子的结构示意图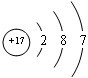 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键
;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键