题目内容
14.(1)已知:298K、101kpa时,反应Ca0(s)+SO2(g)═CaSO3(g)的△H=-402.0kJ•mol-1,△H-T△S=-345.7kJ•mol-1,若此反应中△H和△S不随温度变化而变化.则保持此反应自发进行的温度低于2127K.(2)已知:H20(1)═H2O(g)的△H=+44.0kJ•mol-1,△S=+118.8J•mol-1•K-1.则水的沸点是97.37°C.
(3)已知在298K时,由石墨生成金刚石的反应的△H=+1.895kJ•mol-1,△H-T△S=2866kJ•mol-1,又已知石墨的熵S石=+5.694J•mol-1•K-1,则金刚石的熵S金=-9615.69J/mol•K(化学反应的熵变是生成物的总熵与反应物的总熵之差),这两种碳的同素异形体中更有序的是金刚石更有序.
分析 (1)依据反应所给焓变和熵变及其温度计算得到熵变,反应自发进行的判断依据是△H-T△S<0得到所需的最低温度;
(2)依据△H-T△S<0计算所需温度;
(3)依据△H-T△S<0计算反应的熵变,结合石墨的熵S石=+5.694J•mol-1•K-1,计算金刚石的熵S金,熵变越小越有序.
解答 解:(1)已知:298K、101kpa时,反应Ca0(s)+SO2(g)═CaSO3(g)的△H=-402.0kJ•mol-1,△H-T△S=-345.7kJ•mol-1,代入数值计算:
-402.0kJ•mol-1-298K△S=-345.7kJ•mol-1,△S=-0.189KJ/mol•K,若此反应中△H和△S不随温度变化而变化.
△H-T△S<0,-402.0KJ/mol-T×(-0.189KJ/mol•K)<0,T=2127K
则保持此反应自发进行的温度低于2127K,
故答案为:2127K;
(2)已知:H20(1)═H2O(g)的△H=+44.0kJ•mol-1,△S=+0.1188kJ•mol-1•K-1.,△H-T△S≤0,44.0KJ/mol-T×(+0.0.1188kJ•mol-1•K-1)≤0
T≤370.37K
则水的沸点=370.37-273=97.37°C,
故答案为:97.37°C;
(3)已知在298K时,由石墨生成金刚石的反应的△H=+1.895kJ•mol-1,△H-T△S=2866kJ•mol-1,△S=-9.61KJ/mol•K=-9610J/mol•K,又已知石墨的熵S石=+5.694J•mol-1•K-1,化学反应的熵变是生成物的总熵与反应物的总熵之差则金刚石的熵S金=-9610J/mol•K-5.694J•mol-1•K-1=-9615.69J/mol•K,金刚石熵小于石墨,金刚石更有序,
故答案为:-9615.69J/mol•K,金刚石更有序.
点评 本题考查了反应自发进行的判断依据分析和计算,熵变是生成物的总熵与反应物的总熵之差,主意熵的单位和焓变单位要统一,题目难度中等.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案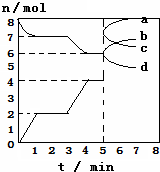 炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容
炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol,如图为CO2、CO的物质的量n随时间t的变化关系图,下列说法正确的( )
| A. | 3min时温度由T1升高到T2,则Q>0,重新平衡时K(T2):K(T1)=14﹕3 | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}$<1 | |
| C. | 0~1min,v(CO)=1mol/(L•min);1~5min时,v正(CO)=v逆(CO2) | |
| D. | 5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
| A. | Na2CO3 | B. | AlCl3 | C. | Na2SO3 | D. | NH4HCO3 |
| A. | CuO→Cu(OH)2 | B. | SO2→Na2SO3 | C. | Fe→FeCl2 | D. | CaCO3→Ca(NO3)2 |
 .
.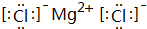 .
. 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
根据原子结构、元素周期表和元素周期律的知识回答下列问题: .
.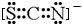 .
.