题目内容
18.NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1L1 mol/L Na2CO3溶液中含阴离子数目小于0.1mol |
分析 A、氦气为单原子分子;
B、依据n=$\frac{m}{M}$计算物质的量,结合石墨烯中平均每个六元环含碳原子2个;
C、溶液体积不明确;
D、CO32-的水解导致阴离子数目增多.
解答 解:A、标况下,22.4L氦气和氟气的物质的量均为1mol,而氦气为单原子分子,故1mol氦气中含1mol原子即NA个,故A错误;
B、12g石墨中碳原子的物质的量n=$\frac{12g}{12g/mol}$=1mol,石墨烯中平均每个六元环含碳原子2个,则1mol碳原子含有六元环的个数为0.5NA,故B正确;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、CO32-的水解导致阴离子数目增多,故溶液中的阴离子的物质的量多于0.1mol,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
8.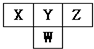 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | Z元素的最高价氧化物的水化物的酸性最强 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
10.下列说法正确的是( )
| A. | 化学的特征是认识分子 | |
| B. | 新制氯水应保存在棕色试剂瓶中,放于阴凉处 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家玻义耳提出原子学说,为近代化学的发展奠定了坚实的基础 |
7.下列说法不正确的是( )
| A. | 检验Cl-离子的试剂是硝酸银和硝酸 | |
| B. | 配制一定物质的量浓度溶液时,未洗涤烧杯和玻璃棒,结果会偏低 | |
| C. | 配制一定物质的量浓度溶液时,容量瓶中有少量蒸馏水,对浓度无影响 | |
| D. | 向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO${\;}_{4}^{2-}$ |
8.已知25℃时,有关弱酸的电离平衡常数如表,则下列有关说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 相同温度时,等物质的量浓度的各溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | 25℃时,等体积、等物质的量浓度的NaCN溶液中阴离子总数小于CH3COONa溶液中阴离子总数 |
 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
根据原子结构、元素周期表和元素周期律的知识回答下列问题: .
.
 .
.