题目内容
【题目】请根据要求填写下列空白:
(1)常温下均为0.02mol/L硫酸和氢氧化钠,等体积混合后溶液的pH=________
(2)常温下,pH都为11的Na2CO3和NaOH溶液中,由水电离出的c(OH-)之比为_____________
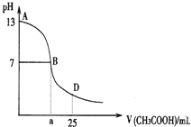
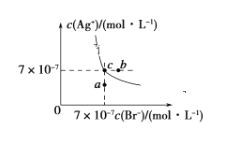
(3)在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知AgCl的Ksp=4×10-10,则 AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=_______________。
AgBr(s)+Cl-(aq)的平衡常数K=_______________。
(4)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,回答下列问题:
H++A2-,回答下列问题:
①NaHA溶液呈________(填“酸”、“碱”、“中”或“无法确定”)性,理由是____________。
②某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
a.溶液pH=7 b.水的离子积Kw=c2(OH-) c.V=10 d.c(K+)<c(Na+)
【答案】2 108:1 816 酸 HA-只电离,不水解 bd
【解析】
(1)先计算酸溶液中H+、碱溶液中OH-的物质的量,判断哪种微粒过量,然后结合水的离子积常数及pH=-lgc(H+)计算反应后溶液的pH;
(2)盐水解促进水的电离,碱NaOH会抑制水的电离;
(3)根据化学平衡常数的含义书写表达式,转化成与溶度积常数的关系分析;
(4)①已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,第一步完全电离,说明HA-离子只电离不水解;
H++A2-,第一步完全电离,说明HA-离子只电离不水解;
②a.根据温度判断溶液的pH;
b.中性溶液中c(OH-)=c(H+);
c.HA-与OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,V<10;
d.根据c选项判断。
(1)常温下均为0.02mol/LH2SO4溶液中,c(H+)=0.04mol/L,0.02mol/L氢氧化钠溶液中OH-的浓度c(OH-)=0.02mol,二者等体积混合后,发生反应H++OH-=H2O,则酸过量,反应后溶液中c(H+)=![]() mol/L=0.01mol/L,所以溶液的pH=2;
mol/L=0.01mol/L,所以溶液的pH=2;
(2)Na2CO3在溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-,常温下,溶液pH=11,溶液中c(H+)=10-11mol/L,由于水的离子积常数Kw=10-14,则溶液中c(OH-)=10-3mol/L,溶液中的OH-是水电离产生的,由于水电离产生的H+、OH-相等,所以pH=11的Na2CO3中由水电离出的c(OH-)=10-3mol/L;NaOH溶液中,碱电离产生OH-对水的电离平衡起抑制作用,pH=11,则c(H+)=10-11mol/L,溶液中的H+就是水电离产生,由于水电离产生的H+、OH-相等,所以pH=11的NaOH溶液中由水电离出的c(OH-)=10-11mol/L;则两种溶液中由水电离出的c(OH-)=10-3mol/L:10-11mol/L=108:1;
HCO3-+OH-,常温下,溶液pH=11,溶液中c(H+)=10-11mol/L,由于水的离子积常数Kw=10-14,则溶液中c(OH-)=10-3mol/L,溶液中的OH-是水电离产生的,由于水电离产生的H+、OH-相等,所以pH=11的Na2CO3中由水电离出的c(OH-)=10-3mol/L;NaOH溶液中,碱电离产生OH-对水的电离平衡起抑制作用,pH=11,则c(H+)=10-11mol/L,溶液中的H+就是水电离产生,由于水电离产生的H+、OH-相等,所以pH=11的NaOH溶液中由水电离出的c(OH-)=10-11mol/L;则两种溶液中由水电离出的c(OH-)=10-3mol/L:10-11mol/L=108:1;
(3)AgCl的溶度积产生Ksp(AgCl)= 4×10-10,根据图象可知AgBr的溶度积产生Ksp(AgBr)=4.9 ×10-13,反应AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=
AgBr(s)+Cl-(aq)的平衡常数K= =816;
=816;
(4)①由HA-![]() H++A2-,可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,HA-电离生成H+,所以溶液显酸性;
H++A2-,可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,HA-电离生成H+,所以溶液显酸性;
②a.由于温度不知道,因此中性时溶液pH不能确定,a错误;
b.中性c(OH-)=c(H+),Kw=c(OH-)·c(H+)=c2(OH-)=KW,b正确;
c.HA-与OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,所以溶液的体积V<10,c错误;
d.根据c选项判断,NaHA过量,所以c(K+)<c(Na+),d正确;
故合理选项是bd。

【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
【题目】下列实验操作能达到实验目的的是()
实验目的 | 实验操作 | |
A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
B | 验证乙醇和浓硫酸可以制备乙烯 | 乙醇和浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
C | 比较HClO和CH3COOH酸性 | 用pH试纸测定浓度均为0.1mol/L的HClO溶液和CH3COOH溶液的pH |
D | Mg(OH)2可溶解于饱和NH4Cl溶液 | 将NH4Cl固体与Mg(OH)2混合 |
A.AB.BC.CD.D