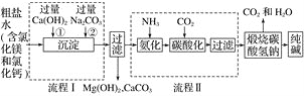
题目内容
【题目】(题文)(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
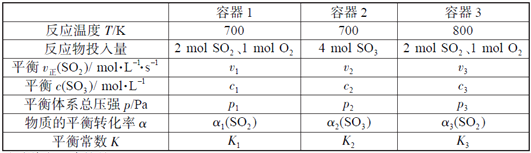
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
【答案】CD
【解析】分析:对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,p2
2c1,p2![]() 2p1,α1(SO2)+α2(SO3)
2p1,α1(SO2)+α2(SO3)![]() 1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3
1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时c3
υ1,升高温度平衡向逆反应方向移动,平衡时c3![]() c1,p3
c1,p3![]() p1,α3(SO2)
p1,α3(SO2)![]() α1(SO2),K3
α1(SO2),K3![]() K1。
K1。
详解:对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,p2
2c1,p2![]() 2p1,α1(SO2)+α2(SO3)
2p1,α1(SO2)+α2(SO3)![]() 1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3
1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时c3
υ1,升高温度平衡向逆反应方向移动,平衡时c3![]() c1,p3
c1,p3![]() p1,α3(SO2)
p1,α3(SO2)![]() α1(SO2),K3
α1(SO2),K3![]() K1。根据上述分析,A项,υ2
K1。根据上述分析,A项,υ2![]() υ1,c2
υ1,c2![]() 2c1,A项错误;B项,K3
2c1,A项错误;B项,K3![]() K1,p2
K1,p2![]() 2p1,p3
2p1,p3![]() p1,则p2
p1,则p2![]() 2p3,B项错误;C项,υ3
2p3,B项错误;C项,υ3![]() υ1,α3(SO2)
υ1,α3(SO2)![]() α1(SO2),C项正确;D项,c2
α1(SO2),C项正确;D项,c2![]() 2c1,c3
2c1,c3![]() c1,则c2
c1,则c2![]() 2c3,α1(SO2)+α2(SO3)
2c3,α1(SO2)+α2(SO3)![]() 1,α3(SO2)
1,α3(SO2)![]() α1(SO2),则α2(SO3)+α3(SO2)
α1(SO2),则α2(SO3)+α3(SO2)![]() 1,D项正确;答案选CD。
1,D项正确;答案选CD。