��Ŀ����
����Ŀ������ʵʩ����ɽ��ˮ�������������о���������������
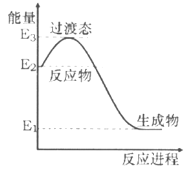
(1)H2�ڴ��������¿ɽ�NO��ԭΪN2����ͼ�Ǹ÷�Ӧ����1 molˮ�����������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ____________(��H����E1��E2��E3��ʾ)��
(2)�ҹ���ѧ������Ȼ�������о�����ȡ�����½�չ��������ͼװ�ÿɷ�����Ӧ��H2S+O2=H2O2+S��
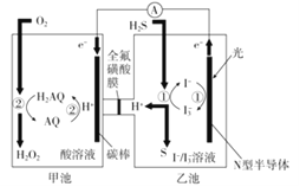
��װ����H+��________��Ǩ�ơ�
���ҳ���Һ�з�����Ӧ�����ӷ���ʽ:____________
(3)2NO(g)+O2(g)![]() 2NO2(g)�ķ�Ӧ��������:
2NO2(g)�ķ�Ӧ��������:
��ӦI:2NO(g)![]() N2O2(g)(��)��
N2O2(g)(��)��![]() <0 v1��=k1�� c2(NO) ��v1��=k1�� c(N2O2)
<0 v1��=k1�� c2(NO) ��v1��=k1�� c(N2O2)
��Ӧ��:N2O2(g)+O2(g)![]() 2NO2(g)(��)
2NO2(g)(��) ![]() 2<0 v2��=k2�� c(N2O2)c(O2) v2��=k2�� c2(NO2)��
2<0 v2��=k2�� c(N2O2)c(O2) v2��=k2�� c2(NO2)��
��һ�������£���Ӧ2NO(g)+O2(g)![]() 2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��=___________(�ú�K1����K1����K2����K2���Ĵ���ʽ��ʾ)��
2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��=___________(�ú�K1����K1����K2����K2���Ĵ���ʽ��ʾ)��
(4)��ˮ����ʱ��ͨH2S(���S2��)��ʹijЩ�����������ɼ����ܵ��������ȥ��25���棬ij��Һ��c(Mn2+)=0.02mol��L��1�����ڷ�Һ��pHʹMn2+��ʼ����ΪMnSʱ����Һ��c(H2S)=0.1mol��L��1����ʱpHԼΪ____��(��֪��Ksp(MnS)=5.0��10-14��H2S�ĵ��볣����K1=1.5��10-7��K2=6.0��10-15��1g6=0.8)
���𰸡�H2(g)+NO(g)=![]() N2(g)+H2O(g) ��H=(E1-E2)kJ/mol �� H2S+I3-=S+2H++3I-
N2(g)+H2O(g) ��H=(E1-E2)kJ/mol �� H2S+I3-=S+2H++3I- ![]() 5.2
5.2
��������
(1)���������仯ͼ����Ӧ��=����Ӧ�Ļ��-�淴Ӧ�Ļ�ܣ��ٸ����Ȼ�ѧ��Ӧ����ʽ����д���
(2)��H+�������ӣ���ɽ϶�������ƶ���
�ڸ���ͼʾ��֪H2S��I3-��Ӧ����S���ʣ�H+��I-���������ʱ仯��д����ʽ��
(3)�ٷ�ӦI��2NO(g)![]() N2O2(g)(��)��
N2O2(g)(��)��
��Ӧ��N2O2(g)+O2(g)![]() 2NO2(g)(��)��
2NO2(g)(��)��
���ݸ�˹���ɣ���+�ڵ�2NO(g)+O2(g)![]() 2NO2(g)��ƽ�ⳣ��K=
2NO2(g)��ƽ�ⳣ��K=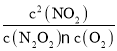 ���ɷ�Ӧ��ƽ��״̬������v1��=v1����v2��=v2��������v1����v2��=v1����v2��������������ֵ������ʽ���Ϳɵõ���ѧƽ�ⳣ���ı���ʽ��
���ɷ�Ӧ��ƽ��״̬������v1��=v1����v2��=v2��������v1����v2��=v1����v2��������������ֵ������ʽ���Ϳɵõ���ѧƽ�ⳣ���ı���ʽ��
(5)��Qc=Ksp(MnS)ʱ��ʼ�������ɴ����S2-��Ũ�ȣ����K1��K2=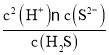 ����������ֵ��������c(H+)��Ȼ��ɼ������Һ��pH��
����������ֵ��������c(H+)��Ȼ��ɼ������Һ��pH��
(1)һ��������H2��ԭNO����N2��1molˮ���������������仯ͼ��֪��Ӧ���ȣ���Ӧ�ʱ���H=E1-E2����Ӧ���Ȼ�ѧ����ʽΪ��H2(g)+NO(g)=![]() N2(g)+H2O(g) ��H=(E1-E2)kJ/mol��
N2(g)+H2O(g) ��H=(E1-E2)kJ/mol��
(2)�ٸ���ͼʾ��֪���������ҳ�����׳�̼����ʹ̼���ϸ���ɽ϶࣬�ҳ��е�H+�������ӣ���ɽ϶��̼�������ƶ��������ҳ���׳��ƶ���
�ڸ���ͼʾ��֪H2S��I3-��Ӧ����S���ʣ�H+��I-����Ӧ����ʽΪ��H2S+I3-=S+2H++3I-��
(3)�ٷ�ӦI��2NO(g)![]() N2O2(g)(��)��
N2O2(g)(��)��
��Ӧ��N2O2(g)+O2(g)![]() 2NO2(g)(��)��
2NO2(g)(��)��
���ݸ�˹���ɣ���+�ڵ�2NO(g)+O2(g)![]() 2NO2(g)��ƽ�ⳣ��K=
2NO2(g)��ƽ�ⳣ��K=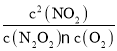 ���ɷ�Ӧ��ƽ��״̬������v1��=v1����v2��=v2��������v1����v2��=v1����v2����k1�� c2(NO)��k2�� c(N2O2)c(O2)= k1�� c(N2O2)��k2�� c2(NO2)����K=
���ɷ�Ӧ��ƽ��״̬������v1��=v1����v2��=v2��������v1����v2��=v1����v2����k1�� c2(NO)��k2�� c(N2O2)c(O2)= k1�� c(N2O2)��k2�� c2(NO2)����K=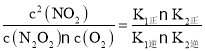 ��
��
(4)��Qc=Ksp(MnS)ʱ��ʼ����������c(S2-)=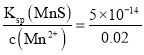 mol/L=2.5��10-12mol/L��
mol/L=2.5��10-12mol/L��
H2S�ĵ��볣����K1=1.5��10-7��K2=6.0��10-15��K1��K2=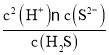 =1.5��10-7��6.0��10-15=9.0��10-22�����c(H2S)=0.1mol/L��֪��c(H+)=
=1.5��10-7��6.0��10-15=9.0��10-22�����c(H2S)=0.1mol/L��֪��c(H+)=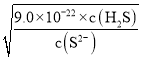 =6��10-6mol/L�����ʱ��Һ��pH=-lg6��10-6=6-lg6=6-0.8=5.2��
=6��10-6mol/L�����ʱ��Һ��pH=-lg6��10-6=6-lg6=6-0.8=5.2��