题目内容
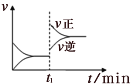
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
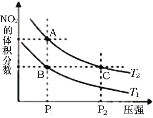
A.由状态B到状态A,可以用加热的方法
B.A、C两点气体的颜色:A深,C浅
C.A、C两点的反应速率:A>C
D.A、C两点气体的平均相对分子质量:A>C
【答案】A
【解析】
N2O4(g)![]() 2NO2(g)△H=+57kJmol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答;
2NO2(g)△H=+57kJmol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答;
A. 升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,A正确;
B. 由图象可知,A、C两点都在等温线上,C的压强比A的大,C点平衡是A点平衡向逆方向移动所得,因为减小了体积增大压强,按勒夏特列原理,NO2浓度大小排序为:增压瞬间的浓度>C点时的浓度>A点时的浓度,NO2为红棕色气体,则A. C两点气体的颜色:A浅,C深,B错误;
C. 由图象可知,A. C两点都在等温线上,C的压强大,则反应速率:A<C,C错误;
D. 由图象可知,A. C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则按![]() 知,平均相对分子质量:A<C,D错误;
知,平均相对分子质量:A<C,D错误;
答案选A。

【题目】在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=akJ·mol-1
CO(g)+H2O(g) ΔH=akJ·mol-1
其化学平衡常数K和温度T的关系如下表所示:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述正确的是
A.a<0
B.可测量容器总压强变化来判定化学反应是否达到平衡
C.温度为830℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v正>v逆
D.温度不变,增大c(CO2),平衡右移,K增大