题目内容
【题目】向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。则下列说法不正确的是
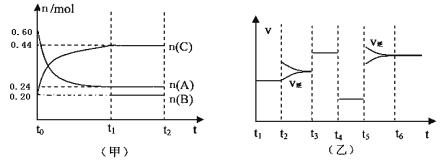
A.若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L·s)
B.B既不是反应物,也不是生成物,可能是反应的催化剂
C.若t2—t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小。
D.该反应为放热反应,t5—t6阶段是升高反应体系的温度
【答案】C
【解析】
试题由图甲可知,t0—t1阶段A的物质的量降低,为反应物,C的物质的量增加为生成物,正反应是一个体积减小的反应; A、t0—t1阶段A的物质的量由0.60mol降为0.24mol,若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为(0.60mol-0.24mol)/4L/15s=0.006mol/(L·s) ,A正确;B、B既不是反应物,也不是生成物,可能是反应的催化剂,B正确;C、若t2—t3阶段改变的条件是增大A的浓度,则容器内的压强增大,平衡向体积减小的方向移动,平衡时C的体积分数变大,C错误;D、该反应为放热反应,t5—t6阶段是升高反应体系的温度,正、逆反应速率增大,平衡向逆反应方向移动,D正确;答案选C。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。