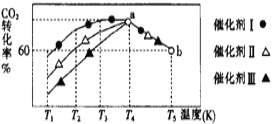
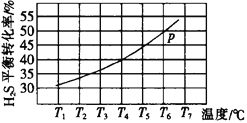
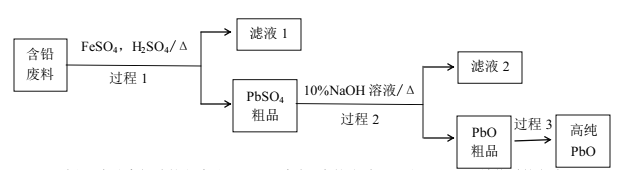
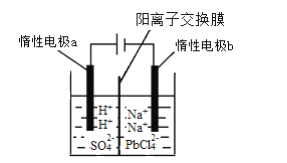
题目内容
【题目】已知:A是来自石油的重要的基本有机化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。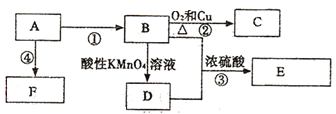
(1)A的电子式为____,C的名称_____,F的结构简式_____。
(2)D分子中的官能团名称是_____,请设计一种实验来验证D物质存在该官能团的方法是_____。
(3)写出下列反应的化学方程式并指出反应类型:③_______,反应类型_____。
【答案】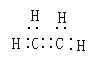 乙醛
乙醛 ![]() 羧基 D与碳酸氢钠溶液混合,若有气泡产生,则D中含有羧基。 CH3COOH+C2H5OH
羧基 D与碳酸氢钠溶液混合,若有气泡产生,则D中含有羧基。 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应
CH3COOC2H5+H2O 酯化反应
【解析】
A的产量可以用来衡量一个国家的石油化工水平,A是乙烯;乙烯通过加聚反应生成聚乙烯,F是聚乙烯;E是具有果香味的有机物,E是乙酸乙酯,根据逆推法,B是乙醇,乙烯与水发生加成反应生成乙醇;乙醇可被酸性高锰酸钾氧化为乙酸,D是乙酸;乙醇在铜作催化剂的条件下被氧气氧化为乙醛,C是乙醛。
根据以上分析,(1)A是乙烯,乙烯的电子式为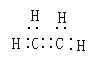 ,乙醇在铜作催化剂的条件下被氧气氧化为乙醛,C的名称乙醛,乙烯通过加聚反应生成聚乙烯,聚乙烯F是的结构简式
,乙醇在铜作催化剂的条件下被氧气氧化为乙醛,C的名称乙醛,乙烯通过加聚反应生成聚乙烯,聚乙烯F是的结构简式![]() 。
。
(2)乙醇可被酸性高锰酸钾氧化为乙酸,D是乙酸,乙酸分子中的官能团名称是羧基,羧基具有酸性,能与碳酸氢钠反应放出二氧化碳,验证D物质存在羧基的方法是:D与碳酸氢钠溶液混合,若有气泡产生,则D中含有羧基。
(3)反应③是乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,反应方程式是CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,反应类型为酯化反应。
CH3COOC2H5+H2O,反应类型为酯化反应。

【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
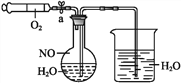
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。