题目内容
(1)已知2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式 .
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式 .
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 .
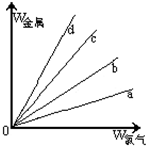
(4)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ,如果横轴表示消耗掉的氯气的质量,则b表示的是四种金属中的 .
(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,写出符合此反应的离子方程式 .
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
(4)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是

(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,写出符合此反应的离子方程式
考点:钠的化学性质,氯气的化学性质,氯、溴、碘及其化合物的综合应用,常见金属元素的单质及其化合物的综合应用
专题:元素及其化合物
分析:(1)水作还原剂的置换反应,说明该反应中水失电子化合价升高,且有氧气生成;
(2)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(4)依据消耗相同物质的量的Cl2,分别消耗金属的量判断;
(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI.
(2)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(4)依据消耗相同物质的量的Cl2,分别消耗金属的量判断;
(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI.
解答:
解:(1)水作还原剂的置换反应,说明该反应中水失电子化合价升高,且有氧气生成,反应方程式为2F2+2H2O=4HF+O2↑,故答案为:2F2+2H2O=4HF+O2↑;
(2)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,离子方程式为MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,离子方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应1molCl2,则分别消耗2molNa、1molCu、
molAl和
mol Fe,消耗四种金属的质量分别为:钠:46g、Cu:64g、铝:18g、铁:37.3g;
所以消耗相同量的氯气,消耗铁的质量仅次于消耗钠的质量,
故选:b;
故答案为:b;Na;
(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI,所以离子反应方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2.
(2)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,离子方程式为MnO2+2Cl-+4H+
| ||
| ||
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,离子方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应1molCl2,则分别消耗2molNa、1molCu、
| 2 |
| 3 |
| 2 |
| 3 |
所以消耗相同量的氯气,消耗铁的质量仅次于消耗钠的质量,
故选:b;
故答案为:b;Na;
(5)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI,所以离子反应方程式为2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2.
点评:本题考查了金属的性质,涉及氧化还原反应、图象分析等知识点,根据元素化合价变化确定生成物、反应方程式,再结合转移电子分析解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
相对分子质量为100的烃完全燃烧后,生成CO2和H2O的物质的量之比以及分子结构中有四个甲基的同分异构体的数目分别是( )
| A、6:7和2 |
| B、6:7和3 |
| C、7:8和3 |
| D、7:8和4 |
下列有关环境问题的说法中正确的是( )
| A、空气质量报告的各项指标中,有二氧化硫、二氧化氮和二氧化碳的指数 |
| B、pH在5.6~7.0之间的降水可通常称为酸雨 |
| C、含氮、磷合成洗涤剂可以被细菌分解,故不会导致水体污染 |
| D、汽车尾气中氮氧化物、一氧化碳、碳氢化合物和颗粒等,严重污染大气 |
