题目内容
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.请回答:
(1)简要阐述上述产生混合气体的理由(用化学方程式回答)?
(2)NO、NO2的体积各为多少升?
(3)待产生的气体全部释放后,向溶液加入450mL 2mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为多少?
(1)简要阐述上述产生混合气体的理由(用化学方程式回答)?
(2)NO、NO2的体积各为多少升?
(3)待产生的气体全部释放后,向溶液加入450mL 2mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)铜与浓硝酸反应得到二氧化氮,随反应进行浓硝酸变稀,铜与稀硝酸反应得到NO;
(2)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=
计算.
(2)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=
| n |
| V |
解答:
解:(1)铜与浓硝酸反应得到硝酸铜、二氧化氮与水,随反应进行浓硝酸变稀,铜与稀硝酸反应生成硝酸铜、NO与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故得到混合气体,
答:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(2)32.64g铜的物质的量为
=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为
=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
答:NO的体积为5.824L,NO2的体积为5.376L.
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=0.45L×2mol/L=0.9mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=0.9mol+0.5mol=1.4mol,故硝酸的物质的量浓度=
=10mol/L,
答:原硝酸溶液的浓度为10mol/L.
答:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(2)32.64g铜的物质的量为
| 32.64g |
| 64g/mol |
| 11.2L |
| 22.4L/mol |
令NO和NO2的物质的量分别为xmol、ymol,则:
|
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
答:NO的体积为5.824L,NO2的体积为5.376L.
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=0.45L×2mol/L=0.9mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=0.9mol+0.5mol=1.4mol,故硝酸的物质的量浓度=
| 1.4mol |
| 0.14L |
答:原硝酸溶液的浓度为10mol/L.
点评:本题考查化学方程式计算,难度中等,注意利用守恒思想进行解答.

练习册系列答案
相关题目
下列金属材料中,最适合制造飞机外壳的是( )
| A、镁铝合金 | B、铜合金 |
| C、碳素钢 | D、钠钾合金 |
由日本和中国科学家相继发现的新的高温超导材料--铁基超导材料:其成分是氟、镧(La)、氧、铁、砷(As)化合物.下列有关该材料的判断正确的是( )
| A、在周期表中,该材料所含五种元素有两种位于主族 |
| B、该超导材料所含五种元素有两种金属元素,三种非金属元素 |
| C、该超导体材料耐酸腐蚀 |
| D、在周期表中,铁属主族元素 |
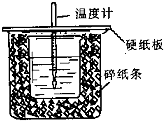
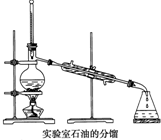 实验室中常采用如图所示装置进行石油分馏,请回答下列问题:
实验室中常采用如图所示装置进行石油分馏,请回答下列问题: