题目内容
将4.2克某金属溶于240mL稀硝酸溶液,反应中收集到标准况下的NO 1.68L,然后又向稀硝酸中加入该金属的氧化物RO 6.48g,恰好完全反应,并放出气体,反应完全后,溶液中的金属离子为R3+.请填空:
(1)金属R的相对原子质量是 .
(2)原稀硝酸溶液的物质的量浓度是 mol/L.
(3)反应中被还原的硝酸的物质的量是 mol.
(1)金属R的相对原子质量是
(2)原稀硝酸溶液的物质的量浓度是
(3)反应中被还原的硝酸的物质的量是
考点:化学方程式的有关计算
专题:计算题
分析:(1)由题目信息可知,金属与稀硝酸反应时,硝酸有剩余,故金属生成R3+,根据电子转移守恒计算计算R的相对原子质量;
(2)反应中硝酸起酸性与氧化性作用,起酸性作用的硝酸生成R(NO3)3,起氧化剂作用的硝酸生成NO,金属计算R、RO的物质的量,根据原子守恒计算起酸性作用的硝酸,根据电子转移守恒计算起氧化剂作用的硝酸,二者之和为总硝酸物质的量,进而计算原硝酸溶液物质的量浓度;
(3)起氧化剂作用的硝酸被还原的硝酸NO.
(2)反应中硝酸起酸性与氧化性作用,起酸性作用的硝酸生成R(NO3)3,起氧化剂作用的硝酸生成NO,金属计算R、RO的物质的量,根据原子守恒计算起酸性作用的硝酸,根据电子转移守恒计算起氧化剂作用的硝酸,二者之和为总硝酸物质的量,进而计算原硝酸溶液物质的量浓度;
(3)起氧化剂作用的硝酸被还原的硝酸NO.
解答:
解:(1)由题目信息可知,金属与稀硝酸反应时,硝酸有剩余,故金属生成R3+,令金属R的相对原子质量为x,根据电子转移守恒,则:
×3=
×(5-2),解得x=56,
故答案为:56;
(2)4.2 g Fe的物质的量=
=0.075mol,6.48g FeO的物质的量=
=0.09mol,
反应中硝酸起酸性与氧化性作用,起酸性作用的硝酸生成Fe(NO3)3,起氧化剂作用的硝酸生成NO,根据电子转移守恒可知,NO总物质的量=
=0.105mol,根据原子守恒,总硝酸物质的量=(0.075mol+0.09mol)×3+0.105mol=0.6mol,原硝酸溶液物质的量浓度=
=2.5mol/L,
故答案为:2.5;
(3)起氧化剂作用的硝酸被还原的硝酸NO,根据N元素守恒可知,被还原的硝酸物质的量=NO总物质的量=
=0.105mol,
故答案为:0.105.
| 4.2 |
| x |
| 1.68 |
| 22.4 |
故答案为:56;
(2)4.2 g Fe的物质的量=
| 4.2g |
| 56g/mol |
| 6.48g |
| 72g/mol |
反应中硝酸起酸性与氧化性作用,起酸性作用的硝酸生成Fe(NO3)3,起氧化剂作用的硝酸生成NO,根据电子转移守恒可知,NO总物质的量=
| 0.075mol×3+0.09mol×1 |
| 5-2 |
| 0.6mol |
| 0.24L |
故答案为:2.5;
(3)起氧化剂作用的硝酸被还原的硝酸NO,根据N元素守恒可知,被还原的硝酸物质的量=NO总物质的量=
| 0.075mol×3+0.09mol×1 |
| 5-2 |
故答案为:0.105.
点评:本题考查氧化还原反应有关计算,难度中等,注意利用电子转移守恒与原子守恒进行解答.

练习册系列答案
相关题目
一定条件下存在反应:A(g)+B(g)?C(g)+D(g)△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol A和1mol B,在Ⅱ中充入1mol C和1mol D,在Ⅲ中充入2mol A和2mol B,500℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D、容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1 |
既能与稀硫酸反应,又能与NaOH溶液反应,且都有气体放出的是( )
| A、NaHCO3 |
| B、(NH4)2CO3 |
| C、Al(OH)3 |
| D、Al2O3 |
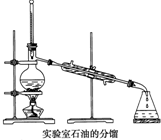 实验室中常采用如图所示装置进行石油分馏,请回答下列问题:
实验室中常采用如图所示装置进行石油分馏,请回答下列问题:
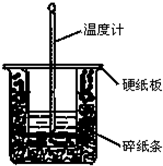 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: