题目内容
【题目】按要求完成下列问题:
![]()
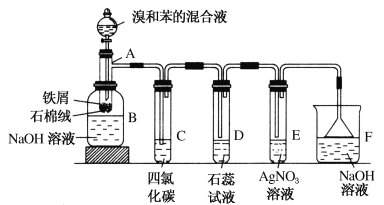
(1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。
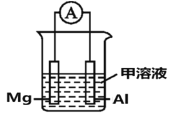
(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。
(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。
(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。
【答案】Al3+ + 3AlO2- +4H2O =4Al(OH)3↓ Ba(NO3)2 AgNO3 C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol 2H+ + 2e- = H2↑ Al - 3e- + 4OH- = AlO2 -+ 2H2O CH3OH- 6e- + 8OH- = CO32-+6 H2O 12.8
【解析】
(1)根据A、B、C之间的转化关系,若A为AlCl3,AlCl3可以与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠反应生成偏铝酸钠,氯化铝与偏铝酸钠能够反应生成氢氧化铝沉淀,据此分析解答;
(2)检验Na2SO4和NaCl混合溶液中的Cl-需要首先除去硫酸根离子,防止硫酸根离子的干扰,据此分析解答;
(3)根据H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,书写出相关的热化学方程式,再根据盖斯定律分析解答;
(4)Mg、Al设计成原电池装置:若电解液为盐酸,镁比铝活泼,镁为负极,铝为正极;若电解液为氢氧化钠溶液,镁与氢氧化钠不反应,此时铝为负极,镁为正极,据此分析解答;
(5)用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料时,负极上甲醇发生氧化反应生成碳酸根离子,据此书写负极的电极反应式;
(6)铅蓄电池的总反应为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,据此分析解答。
2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,据此分析解答。
(1)根据A、B、C之间的转化关系,若A为AlCl3,AlCl3可以与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠反应生成偏铝酸钠,氯化铝与偏铝酸钠能够反应生成氢氧化铝沉淀,因此A和C反应的离子方程式为Al3+ + 3AlO2- +4H2O =4Al(OH)3↓,故答案为:Al3+ + 3AlO2- +4H2O =4Al(OH)3↓;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量Ba(NO3)2溶液,充分震荡后静置,除去硫酸根离子,防止硫酸根离子的干扰,然后取上层清液于试管中,再加入几滴AgNO3溶液,产生白色沉淀,可以检验Na2SO4和NaCl混合溶液中的Cl-,故答案为:Ba(NO3)2;AgNO3;
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,①H2(g)+![]() O2(g)=H2O(l)△H=-akJmol-1,②CO(g)+
O2(g)=H2O(l)△H=-akJmol-1,②CO(g)+![]() O2(g)=CO2(g)△H=-bkJmol-1,1mol液态水变为气态水吸收ckJ热量,则③H2O(l)= H2O(g) △H=+ckJ∕mol,④C(s) + H2O(g)= CO(g)+ H2(g)△H=+dkJ∕mol,依据盖斯定律,将①+②+③+④得:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol,故答案为:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol;
O2(g)=CO2(g)△H=-bkJmol-1,1mol液态水变为气态水吸收ckJ热量,则③H2O(l)= H2O(g) △H=+ckJ∕mol,④C(s) + H2O(g)= CO(g)+ H2(g)△H=+dkJ∕mol,依据盖斯定律,将①+②+③+④得:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol,故答案为:C(s)+O2(g) =CO2(g) H=-(a+b-d-c)kJ/mol;
(4)Mg、Al设计成原电池装置:若电解液为盐酸,镁比铝活泼,镁为负极,铝为正极,正极的电极反应为2H+ + 2e- = H2↑。若电解液为氢氧化钠溶液,镁与氢氧化钠不反应,此时铝为负极,负极的电极反应式为Al - 3e- + 4OH- = AlO2-+ 2H2O,故答案为:2H+ + 2e- = H2↑;Al - 3e- + 4OH- = AlO2-+ 2H2O;
(5)用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料时,负极上甲醇发生氧化反应生成碳酸根离子,负极的电极反应式为CH3OH- 6e- + 8OH- = CO32-+6 H2O,故答案为:CH3OH- 6e- + 8OH- = CO32-+6 H2O;
(6)铅蓄电池的总反应为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4。若铅蓄电池负极质量增加19.2g,转移的电子的物质的量为
2PbSO4+2H2O,Pb为负极,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4。若铅蓄电池负极质量增加19.2g,转移的电子的物质的量为![]() ×2=0.4mol,则正极上0.2mol PbO2转化为0.2mol PbSO4,质量增加的量相当于增加了0.2molSO2,质量为0.2mol×64g/mol=12.8g,故答案为:12.8。
×2=0.4mol,则正极上0.2mol PbO2转化为0.2mol PbSO4,质量增加的量相当于增加了0.2molSO2,质量为0.2mol×64g/mol=12.8g,故答案为:12.8。

 阅读快车系列答案
阅读快车系列答案【题目】(1)填写下列表格:
物质 | 分子数 | 质量/g | 物质的量/ mol | 摩尔质量/(g |
O2 | __ | 8.0 | __ | __ |
H2SO4 | 3.01×1023 | __ | __ | __ |
H2O | __ | __ | 0.5 | __ |
(2)147gH2SO4的物质的量是____;0.5molH2SO4的质量是____g,其中含有____mol H;2 mol H2SO4中含有H2SO4分子数为_____个,含氢原子数为____个。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____,R的相对原子质量为____。含R的质量为1.6 g的Na2R,其物质的量为____。