题目内容
【题目】(1)填写下列表格:
物质 | 分子数 | 质量/g | 物质的量/ mol | 摩尔质量/(g |
O2 | __ | 8.0 | __ | __ |
H2SO4 | 3.01×1023 | __ | __ | __ |
H2O | __ | __ | 0.5 | __ |
(2)147gH2SO4的物质的量是____;0.5molH2SO4的质量是____g,其中含有____mol H;2 mol H2SO4中含有H2SO4分子数为_____个,含氢原子数为____个。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____,R的相对原子质量为____。含R的质量为1.6 g的Na2R,其物质的量为____。
【答案】0.25![]() 6.02
6.02![]() 1023 0.25mol 32g/mol 49g 0.5mol 98g/mol 0.5
1023 0.25mol 32g/mol 49g 0.5mol 98g/mol 0.5![]() 6.02
6.02![]() 1023 9g 18g/mol 1.5mol 49 1 2
1023 9g 18g/mol 1.5mol 49 1 2![]() 6.02
6.02![]() 1023 4
1023 4![]() 6.02
6.02![]() 1023 62g/mol 16 0.1mol
1023 62g/mol 16 0.1mol
【解析】
根据n=![]() =
=![]() 并结合物质的化学式进行计算和判断。
并结合物质的化学式进行计算和判断。
(1) O2的相对分子质量是32,则其摩尔质量为32g/mol,质量是8g、则O2的物质的量为n(O2)=![]() =
=![]() =0.25mol,分子数为0.25
=0.25mol,分子数为0.25![]() 6.02
6.02![]() 1023;H2SO4的相对分子质量为98,则其摩尔质量为98g/mol,分子数为3.01×1023,则H2SO4的物质的量为n(H2SO4)=
1023;H2SO4的相对分子质量为98,则其摩尔质量为98g/mol,分子数为3.01×1023,则H2SO4的物质的量为n(H2SO4)=![]() =
=![]() =0.5mol,质量为m(H2SO4)=n×M=0.5mol×98g/mol=49g;H2O的相对分子质量是18,则其摩尔质量为18g/mol,H2O的物质的量为0.5mol,则分子数为0.5
=0.5mol,质量为m(H2SO4)=n×M=0.5mol×98g/mol=49g;H2O的相对分子质量是18,则其摩尔质量为18g/mol,H2O的物质的量为0.5mol,则分子数为0.5![]() 6.02
6.02![]() 1023,质量是m(H2O)=n×M=0.5mol×18g/mol=9g;
1023,质量是m(H2O)=n×M=0.5mol×18g/mol=9g;
(2) 147gH2SO4的物质的量是n(H2SO4)=![]() =
=![]() =1.5mol;0.5molH2SO4的质量是m(H2SO4)=n×M=0.5mol×98g/mol=49g,1个H2SO4分子中含有2个H原子,则0.5molH2SO4中含有1mol H;2 mol H2SO4中含有H2SO4分子数为2
=1.5mol;0.5molH2SO4的质量是m(H2SO4)=n×M=0.5mol×98g/mol=49g,1个H2SO4分子中含有2个H原子,则0.5molH2SO4中含有1mol H;2 mol H2SO4中含有H2SO4分子数为2![]() 6.02
6.02![]() 1023个,含氢原子数为4
1023个,含氢原子数为4![]() 6.02
6.02![]() 1023个。
1023个。
(3) 12.4gNa2R含Na+0.4mol,根据化学式可知,Na2R的物质的量为0.2mol,则Na2R的摩尔质量为M=![]() =
=![]() =62g/mol,R的相对原子质量为62-2×23=16。含R的质量为1.6 g的Na2R,R的物质的量为
=62g/mol,R的相对原子质量为62-2×23=16。含R的质量为1.6 g的Na2R,R的物质的量为![]() =0.1mol,则Na2R的物质的量也是0.1mol。
=0.1mol,则Na2R的物质的量也是0.1mol。

【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+ 6H2(g) ![]() CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图
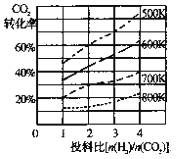
①该反应的ΔH ________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将________(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.混气的颜色 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO2 3.0 mol H2 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 ________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
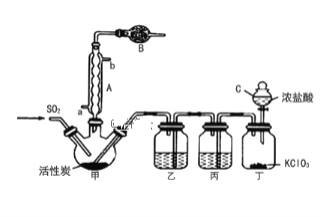
(1)仪器B的名称是______,作用是________。
(2)若无装置乙硫酰氯会发生水解,则硫酰氯水解反应的化学方程式为_______。
(3)写出丁装置中发生反应的化学反应方程式____________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有____(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快③若三颈烧瓶发烫,可适当降温④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为______。此方法得到的产品中会混有硫酸,从分解产物中分离出硫酰氯的方法是_____。
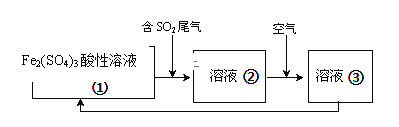
(6)工业上处理SO2废气的方法很多,例如可以用Fe2(SO4)3酸性溶液处理,其工艺流程如下,溶液②转化为溶液③发生反应的离子方程式为_________。