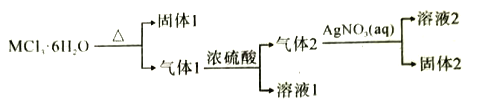
题目内容
【题目】工业上常釆用乙苯催化脱氢制苯乙烯,方程式为:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)已知:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol﹣1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_____kJmol﹣1。
(2)①利用计算结果与反应特点,选择理论上有利于提高苯乙烯平衡产率的条件_____。
A.低温 B.高温 C.高压 D.低压 E.合适的催化剂
②实际工业生产中常伴有乙苯裂解等副反应。而乙苯裂解反应无论在热力学还是在动力学上都比乙苯脱氢更有利,所以工业生产要使反应向脱氢方向进行需要采用_____条件来提高反应的选择性。
③工业生产中常采用恒压条件下向乙苯蒸汽中掺入水蒸气或CO2的办法来提高乙苯的平衡转化率,请从平衡移动的角度加以说明_____。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:
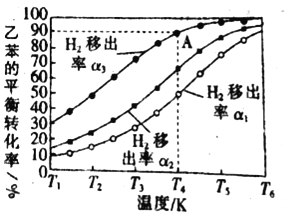
氢气移出率α![]()
①同温度时α1、α2、α3依次_____,(填“增大”“减小”)原因是_____。
②A点平衡常数为0.45mol/L,则α为_____。
【答案】+124 BD 合适的催化剂 压强不变,向乙苯蒸汽中掺入水蒸气或CO2,容器体积增大,平衡正向移动,有利于提高乙苯的平衡转化率 增大 氢气移出率增大,生成物中氢气的浓度降低,有利于平衡正向移动,乙苯转化率升高 94.4%
【解析】
(1)反应热=反应物总键能﹣生成物总能键能,由有机物的结构可知,应是﹣CH2CH3中总键能与﹣CH=CH2、H2总键能之差;
(2)①利用(1)计算结果、结合反应正向是体积增大的反应特点选择有利于提高苯乙烯平衡产率的条件;
②选择合适的催化剂可提高乙苯脱氢的选择性;
③保持压强不变,向乙苯蒸汽中掺入水蒸气或CO2,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
(3)①同温条件下,氢气移出越多,即移出率越高,平衡发生正向移动越多,转化率越高;
②根据反应的三段式结合平衡常数计算平衡时c(H2),利用氢气移出率公式计算氢气移出率a。
(1)反应热=反应物总键能﹣生成物总能键能,由有机物的结构可知,应是﹣CH2CH3中总键能与﹣CH=CH2、H2总键能之差,所以△H=(5×412+348﹣3×412﹣612﹣436)kJmol-1=+124kJmol-1;
(2)①由(1)计算结果可知,反应正向是体积增大的吸热反应,升温或减压均能使平衡正向移动,有利于提高苯乙烯平衡产率,催化剂不影响苯乙烯的平衡产率,所以选择BD;
②合适的催化剂能提高乙苯脱氢的反应速率,抑制乙苯裂解反应,所以工业生产要使反应向脱氢方向进行,需要采用合适的催化剂来提高反应的选择性,故答案为:合适的催化剂;
③反应正向是体积增大的反应,保持压强不变,向乙苯蒸汽中掺入水蒸气或CO2,容器体积增大,等效为降低压强,平衡向气体体积增大的方向移动,故答案为:压强不变,向乙苯蒸汽中掺入水蒸气或CO2,容器体积增大,平衡正向移动,有利于提高乙苯的平衡转化率;
(3)①同温条件下,氢气移出越多,即移出率越高,体系中生成物浓度越低,平衡发生正向移动越多,乙苯转化率越高,所以氢气移出率越高,乙苯转化率越高,即α1<α2<α3,故答案为:增大;氢气移出率增大,生成物中氢气的浓度降低,有利于平衡正向移动,乙苯转化率升高;
②A点时乙苯的转化率为90%,转化的物质的量为0.9mol,整个过程中生成H2的物质的量为0.9mol,设平衡时体系中H2的物质的量为x,平衡体系中c(乙苯)=0.1mol/L,c(苯乙烯)=0.9mol/L,c(H2)=xmol/L,平衡常数![]() ,解得x=0.05mol,氢气移出率α=
,解得x=0.05mol,氢气移出率α=![]() =94.4%,故答案为:94.4%。
=94.4%,故答案为:94.4%。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案