题目内容
【题目】碳酸亚铁在空气中灼烧得到铁的氧化物A和一种气体。某学习小组为了探究该氧化物A的组成设计了两种实验方案:
方案Ⅰ
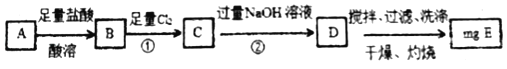
(1)若该方案中①通入Cl2不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是_____(用化学方程式表示)
(2)若氧化物A的质量是7.8400g,E的质量为8.0000g根据数据计算化合物A的化学式为_____。
方案Ⅱ
①称取ag氧化物A样品溶于足量稀硫酸,并配成100mL溶液。
②取20.00 mL该溶液于锥形瓶中,滴加几滴KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生少量气泡(资料显示SCN-可被H2O2氧化,产物为N2、CO2、SO42﹣)
③待气泡消失后,用 b mol/LKI标准溶液滴定锥形瓶中的Fe3+,滴定终点时消耗cmL KI标准溶液。
(3)该方案用到的定量仪器有量筒、分析天平、酸式滴定管、_____。
(4)步骤②中滴加KSCN溶液的目的是_____。
(5)补充完整该实验步骤③用到的酸式滴定管的润洗操作:关闭滴定管旋塞,从上口注入3﹣5mL待装液,_____,重复2﹣3次。
(6)步骤③能否选用淀粉作指示剂_____。(填“能”或“否”)
(7)有的同学通过查阅相关资料对该小组的实验设计进行了评价,以下说法合理的是_____
A.资料显示:HSCN有剧毒,易挥发。因此该方案步骤②可能因产生HSCN而不符合实验安全性的要求。
B.步骤②若加入H2O2过量,后续步骤不加以处理也不会对实验结果造成任何影响。
C.资料显示:Fe3+和I﹣之间的反应是明显的可逆反应,这样步骤③就会造成滴定测定不准确
(8)有的同学对碳酸亚铁的获得产生了兴趣。通过查阅资料发现碳酸亚铁可通过碳酸氢钠和硫酸亚铁发生Fe2++2HCO3﹣FeCO3↓+H2CO3制得,请计算该反应的平衡常数K=_____(mol/L)﹣2可能用到的缴据如下:Ksp(FeCO3)=3.20×10﹣11,H2CO3的Ka1=4.30×10﹣7,Ka2=5.61×10﹣11。
【答案】4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe5O7 100mL容量瓶 指示亚铁离子刚好被氧化为铁离子,且过氧化氢不过量 倾斜着转动滴定管,使液体润湿全部滴定管内壁,一手控制活塞,使液体从滴定管下部放入预置的烧杯中 否 AC 4.08×106
【解析】
由流程可知,A与盐酸反应生成盐,B中加氯气可氧化亚铁离子,C中含铁离子,与NaOH反应生成D为Fe(OH)3,D灼烧分解生成E为Fe2O3。
(1)若该方案中①通入Cl2不足量,在空气中充分搅拌D时氢氧化亚铁被氧化生成氢氧化铁;
(2)氧化物A的质量是7.8400g,E的质量为8.0000g,由Fe元素守恒可知,A中含Fe为![]() =0.1mol,A中含O为
=0.1mol,A中含O为![]() =0.14mol;
=0.14mol;
(3)配100mL溶液需要100mL容量瓶;
(4)滴加KSCN溶液可判断亚铁离子被氧化为铁离子;
(5)润洗后液体润湿全部滴定管内壁;
(6)铁离子为黄色,不需要加指示剂;
(7)A.HSCN有剧毒,不符合绿色化学的要求;
B.加入H2O2过量,可氧化碘离子;
C.Fe3+和I﹣之间的反应是明显的可逆反应,消耗标准液的体积不准确;
(8)![]() 的平衡常数K=
的平衡常数K=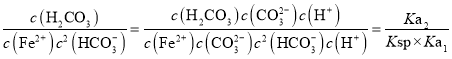 。
。
(1)若该方案中①通入Cl2不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,依据是4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)氧化物A的质量是7.8400g,E的质量为8.0000g,由Fe元素守恒可知,A中含Fe为![]() =0.1mol,A中含O为
=0.1mol,A中含O为![]() =0.14mol,Fe、O的原子个数比为5:7,A的化学式为Fe5O7;
=0.14mol,Fe、O的原子个数比为5:7,A的化学式为Fe5O7;
(3)该方案用到的定量仪器有量筒、分析天平、酸式滴定管、100mL容量瓶,故答案为:100mL容量瓶;
(4)步骤②中滴加KSCN溶液的目的是指示亚铁离子刚好被氧化为铁离子,且过氧化氢不过量,故答案为:指示亚铁离子刚好被氧化为铁离子,且过氧化氢不过量;
(5)步骤③用到的酸式滴定管的润洗操作:关闭滴定管旋塞,从上口注入3﹣5mL待装液,倾斜着转动滴定管,使液体润湿全部滴定管内壁,一手控制活塞,使液体从滴定管下部放入预置的烧杯中,重复2﹣3次,故答案为:倾斜着转动滴定管,使液体润湿全部滴定管内壁,一手控制活塞,使液体从滴定管下部放入预置的烧杯中;
(6)铁离子为黄色,不需要加淀粉作指示剂,故答案为:否;
(7)A.HSCN有剧毒,不符合绿色化学的要求,则步骤②可能因产生HSCN而不符合实验安全性的要求,故A正确;
B.加入H2O2过量,可氧化碘离子,影响标准液的体积,故B错误;
C.Fe3+和I-之间的反应是明显的可逆反应,消耗标准液的体积不准确,样步骤③就会造成滴定测定不准确,故C正确;
故答案为:AC;
(8)![]() 的平衡常数K=
的平衡常数K=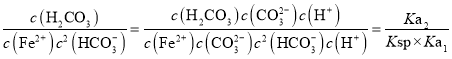 =
=![]() =4.08×106。
=4.08×106。

【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为___________,装置F中试剂的作用是__________。
②装置连接顺序:A→_______________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和_____________。
(2)S2Cl2遇水强烈反应产生烟雾,该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案_________(填“可行”或“不可行”),原因是___________。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是____________(填标号)。
aH2O2溶液 bKMnO4溶液(硫酸酸化) c氯水
②该混合气体中气体X的体积分数为_____________(用含V、m的式子表示)。
【题目】工业上常釆用乙苯催化脱氢制苯乙烯,方程式为:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)已知:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol﹣1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_____kJmol﹣1。
(2)①利用计算结果与反应特点,选择理论上有利于提高苯乙烯平衡产率的条件_____。
A.低温 B.高温 C.高压 D.低压 E.合适的催化剂
②实际工业生产中常伴有乙苯裂解等副反应。而乙苯裂解反应无论在热力学还是在动力学上都比乙苯脱氢更有利,所以工业生产要使反应向脱氢方向进行需要采用_____条件来提高反应的选择性。
③工业生产中常采用恒压条件下向乙苯蒸汽中掺入水蒸气或CO2的办法来提高乙苯的平衡转化率,请从平衡移动的角度加以说明_____。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:
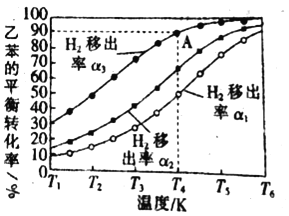
氢气移出率α![]()
①同温度时α1、α2、α3依次_____,(填“增大”“减小”)原因是_____。
②A点平衡常数为0.45mol/L,则α为_____。