��Ŀ����
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72��(��ɫ)+H2O2CrO42��(��ɫ)+2H+.��֪Cr2O72����ǿ�����ԣ���CrO42����û�������ԣ�Cr3+����ɫ����K2Cr2O7��Һ�м����������ʣ�������Һ��ɫ�仯��˵������ȷ����(����)
A.��70%�����ᣬ��Һ���ɫ
B.��30%NaOH��Һ����Һ���ɫ
C.��70%��������ټ�C2H5OH����Һ�ɱ����ɫ
D.��30%NaOH��Һ����Һ���ɫ����C2H5OH�ޱ仯���ټӹ������ᣬ��Һ�������Ա仯
���𰸡�D
��������
K2Cr2O7��Һ�д���ƽ�⣺![]() �������ᣬ������Ũ������ƽ�������ƶ�������Һ��ɫ�������ƽ�������ƶ�����Һ��ƣ���
�������ᣬ������Ũ������ƽ�������ƶ�������Һ��ɫ�������ƽ�������ƶ�����Һ��ƣ���![]() ���н�ǿ�������ԣ��������Ҵ�����
���н�ǿ�������ԣ��������Ҵ�����![]() ���ܣ��Դ˽����⡣
���ܣ��Դ˽����⡣
A����70%�����ᣬ������Ũ������ƽ�������ƶ�����Һ���ɫ����A���������⣻
B����30%NaOH��Һ��������Ũ�ȼ�С��ƽ�������ƶ�����Һ���ɫ����B���������⣻
C������70%�����ᵽ��������ҺΪ���ԣ����ɵ�![]() ���������Ҵ�����Һ����ɫ����C���������⣻
���������Ҵ�����Һ����ɫ����C���������⣻
D����30%NaOH��Һ��ƽ�������ƶ�ʹ��Һ���ɫ����C2H5OH�ޱ仯���ټӹ������ᣬ���ɵ�![]() ���������Ҵ�����Һ��Ϊ��ɫ����D�������⣻
���������Ҵ�����Һ��Ϊ��ɫ����D�������⣻
��ѡ��D��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�����Ŀ����ҵ�ϳ�����ұ��������Ʊ���ϩ������ʽΪ��![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)��֪��
��ѧ�� | C��H | C��C | C��C | H��H |
����/kJmol��1 | 412 | 348 | 612 | 436 |
����������Ӧ�ġ�H��_____kJmol��1��
(2)�����ü������뷴Ӧ�ص㣬ѡ����������������߱���ϩƽ����ʵ�����_____��
A.���� B.���� C.��ѹ D.��ѹ E.���ʵĴ���
��ʵ�ʹ�ҵ�����г������ұ��ѽ�ȸ���Ӧ�����ұ��ѽⷴӦ����������ѧ�����ڶ���ѧ�϶����ұ���������������Թ�ҵ����Ҫʹ��Ӧ�����ⷽ�������Ҫ����_____��������߷�Ӧ��ѡ���ԡ�
�۹�ҵ�����г����ú�ѹ���������ұ������в���ˮ������CO2�İ취������ұ���ƽ��ת���ʣ����ƽ���ƶ��ĽǶȼ���˵��_____��
(3)����Ĥ��Ӧ�¼���������ʵ�ֱ߷�Ӧ�߷�������ɵ�������ͬ�¶��£�1.00mol�ұ����ݻ�Ϊ1.00L���ܱ������з�Ӧ�������Ƴ��������ұ�ƽ��ת���ʹ�ϵ��ͼ��ʾ��
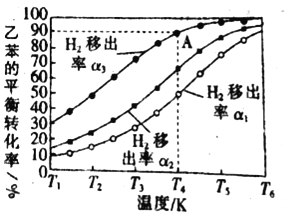
�����Ƴ�����![]()
��ͬ�¶�ʱ��1����2����3����_____��(��������������С��)ԭ����_____��
��A��ƽ�ⳣ��Ϊ0.45mol/L������Ϊ_____��
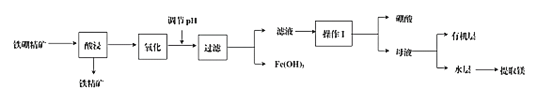
����Ŀ�����仯�����ڹ�ҵ��ҽҩ��ũҵ�Ȳ�����������;��ij����������(��Ҫ�ɷ�ΪB2O3��2MgO������SiO2��CaO��FeO������)��ȡ�����ᡢ����þ�Ĺ�������ͼΪ��
��֪�������ڲ�ͬ�¶��µ��ܽ�ȣ�
�¶�(��) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
�ܽ��(g/100gˮ) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
�ش��������⣺
(1)ʹ�������������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_________��Ϊ��߽������ʣ��ɲ�ȡ�Ĵ�ʩ��_________(д������)��
(2)���ʱ���¶���������ʵĹ�ϵ��ͼ��ʾ������ʵ�����¶�Ϊ_________��

(3)����Һ�����������ǽ���Һ�е�Fe2+��_______�Լ�����ΪFe3+����Ӧ�����ӷ���ʽΪ_________��
(4)����Һ�л��H3BO3�����������I�����������_________��
(5)����Һ�м����л���ȡ����ȡ��Һ����ʱ���ᴦ��_________����(�����л�����������)��ʵ����ģ����ȡ����ʹ�õIJ����������ձ��⣬��һ��Ҫ����������_________��
(6)ij������ m1 kg�������Ʊ����ᣬ�õ�����Ϊ99.8%������m2 kg�����������������������__________(��ʽ����)��