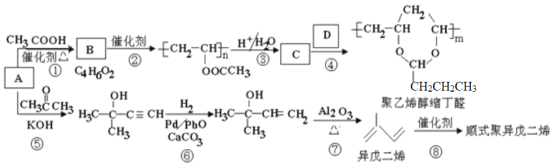
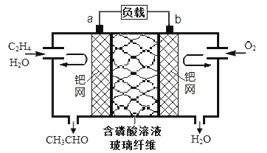
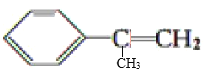
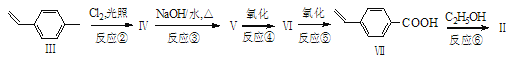题目内容
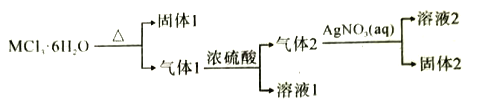
【题目】某常见金属的结晶水化合物MCl3·6H2O有如下转化关系:下列推断正确的是( )
A.固体1一定是既能与盐酸反应,又能与强碱反应
B.气体1通过五水硫酸铜晶体,固体变蓝色
C.常温下,溶液2能溶解铜
D.固体2浊液中滴加Na2S溶液,白色固体变黄色
【答案】C
【解析】
根据流程图,MCl3·6H2O加热分解生成M的氧化物、水蒸气和HCl,则固体1为M的氧化物,气体1为水蒸气和HCl,加入浓硫酸吸水,形成硫酸溶液1和气体2HCl,气体2通入到硝酸银溶液中得到硝酸(溶液2)和氯化银(固体2),据此分析解答。
A.根据题意,M可能是铁或铝,若固体1为氧化铁,氧化铁不和氢氧化钠反应,故A错误;
B.气体1应为HCl和H2O混合物,用无水硫酸铜检验水蒸气,故B错误;
C.溶液2为硝酸,常温下硝酸能溶解铜,故C正确;
D.固体2为氯化银,滴加Na2S溶液,氯化银转化为硫化银,硫化银呈黑色,白色固体变黑色,故D错误;
答案选C。

【题目】工业上常釆用乙苯催化脱氢制苯乙烯,方程式为:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)已知:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol﹣1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_____kJmol﹣1。
(2)①利用计算结果与反应特点,选择理论上有利于提高苯乙烯平衡产率的条件_____。
A.低温 B.高温 C.高压 D.低压 E.合适的催化剂
②实际工业生产中常伴有乙苯裂解等副反应。而乙苯裂解反应无论在热力学还是在动力学上都比乙苯脱氢更有利,所以工业生产要使反应向脱氢方向进行需要采用_____条件来提高反应的选择性。
③工业生产中常采用恒压条件下向乙苯蒸汽中掺入水蒸气或CO2的办法来提高乙苯的平衡转化率,请从平衡移动的角度加以说明_____。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:
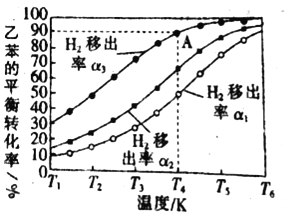
氢气移出率α![]()
①同温度时α1、α2、α3依次_____,(填“增大”“减小”)原因是_____。
②A点平衡常数为0.45mol/L,则α为_____。