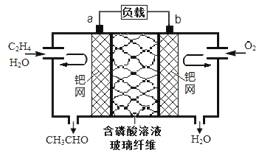
题目内容
【题目】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为 (填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
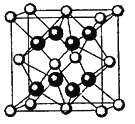
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;

②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H2O B.CH4C.HF D.CO(NH2)2
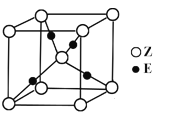
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为_______________;已知其摩尔质量为M g.mol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
【答案】(1)3d24s2;
(2)O>N>C>H;
(3)分子晶体;配位键;
(4)①3种;②BC;③LaNi5;![]() ×1030。
×1030。
【解析】试题A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,则A为H元素;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;E4+与氩原子的核外电子排布相同,则E为Ti元素;F是第四周期d区原子序数最大的元素,则F为Ni元素。
(1)E为22号元素Ti,其价层电子排布式为3d24s2,故答案为:3d24s2;
(2)同周期元素从左到右电负性逐渐增大,电负性由大到小的顺序为O>N>C>H,故答案为:O>N>C>H;
(3)Ni(CO)4熔沸点较低,为分子晶体;Ni为过渡元素容易提供空轨道,而CO提供孤对电子,二者形成配位键,故答案为:分子晶体;配位键;
(4)①图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种,故答案为:3种;
②CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,故答案为:BC;
③该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×![]() =5,晶胞实际含有的镧原子为8×
=5,晶胞实际含有的镧原子为8×![]() =1,所以晶体的化学式LaNi5,晶胞的密度ρ=
=1,所以晶体的化学式LaNi5,晶胞的密度ρ=![]() =
=![]() =
=![]() ×1030,故答案为:LaNi5;
×1030,故答案为:LaNi5;![]() ×1030。
×1030。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为___________,装置F中试剂的作用是__________。
②装置连接顺序:A→_______________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和_____________。
(2)S2Cl2遇水强烈反应产生烟雾,该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案_________(填“可行”或“不可行”),原因是___________。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是____________(填标号)。
aH2O2溶液 bKMnO4溶液(硫酸酸化) c氯水
②该混合气体中气体X的体积分数为_____________(用含V、m的式子表示)。
【题目】工业上常釆用乙苯催化脱氢制苯乙烯,方程式为:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
(1)已知:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol﹣1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_____kJmol﹣1。
(2)①利用计算结果与反应特点,选择理论上有利于提高苯乙烯平衡产率的条件_____。
A.低温 B.高温 C.高压 D.低压 E.合适的催化剂
②实际工业生产中常伴有乙苯裂解等副反应。而乙苯裂解反应无论在热力学还是在动力学上都比乙苯脱氢更有利,所以工业生产要使反应向脱氢方向进行需要采用_____条件来提高反应的选择性。
③工业生产中常采用恒压条件下向乙苯蒸汽中掺入水蒸气或CO2的办法来提高乙苯的平衡转化率,请从平衡移动的角度加以说明_____。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:
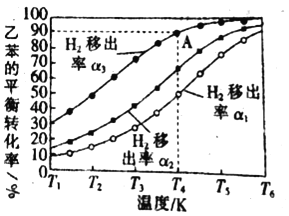
氢气移出率α![]()
①同温度时α1、α2、α3依次_____,(填“增大”“减小”)原因是_____。
②A点平衡常数为0.45mol/L,则α为_____。