题目内容
9.下列物质中既能使溴水褪色,也能使高锰酸钾酸性溶液褪色的是( )| A. | 对二甲苯 | B. | 丙烯 | C. | 丙炔 | D. | 溴乙烷 |
分析 碳碳不饱和键能和溴发生加成反应而使溴水褪色,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,据此分析解答.
解答 解:A.对二甲苯不含碳碳不饱和键,不能和溴发生加成反应,所以不能使溴水褪色,故A错误;
B.丙烯中含有碳碳不饱和键,能和溴发生加成反应而使其褪色,能被酸性高锰酸钾溶液氧化而使其褪色,故B正确;
C.丙炔中含有碳碳不饱和键,能和溴发生加成反应而使其褪色,能被酸性高锰酸钾溶液氧化而使其褪色,故C正确;
D.溴乙烷中不含不饱和键,不能和溴反应,也不能和酸性高锰酸钾溶液反应,所以不能使溴水、酸性高锰酸钾溶液褪色,故D错误;
故选BC.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,注意部分醇类、连接苯环碳原子上含有氢原子的苯的同系物也能被酸性高锰酸钾溶液氧化,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$\stackrel{乙醇}{→}$CH2=CH2↑+NaBr+H2O |
6. 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
则达到平衡时CO的转化率为45%.
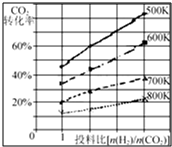
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
17.下列物质中,既有离子键又有共价键的是( )
| A. | Ca(NO3)2 | B. | NaCl | C. | H2O | D. | KOH |
14.下列说法正确的是( )
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 苯和乙醇均不能使酸性高锰酸钾溶液褪色 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质、纤维素、蔗糖、淀粉都是高分子化合物 |
1.对于反应2X(g)+Y(g)?2Z(g),下列说法正确的是( )
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 可逆反应达到平衡时,逆反应便立即停止了 | |
| D. | 温度发生变化,上述的K值也发生变化 |
19.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.0 g重水(D2O)中所含质子数为0.4NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |

