题目内容
【题目】下表是不同温度下的离子积数据:
温度(℃) | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“>”、“>”或“=”)1×10-14,作出此判断的理由是______。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为______。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)=__mol/L。
(3)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L﹣1的NaOH溶液
(4)c(H+)相同的等体积的两份溶液CH3COOH和HCl,分别与足量的锌粉反应,则下列说法正确的是__(填写序号)
a.反应所需要的时间CH3COOH>HCl
b.开始反应时的速率HCl>CH3COOH
c.参加反应的锌粉物质的量二者相等
d.CH3COOH消耗的锌粉的质量更多
【答案】> 水的电离是吸热反应,升高温度,平衡向着正反应方向移动,c(H+)增大,c(OH-)增大,Kw= c(H+)·c(OH-),Kw增大 2.4×10-7mol/L 5.76×10-9mol/L bcf d
【解析】
(1)根据水的电离过程是吸热反应,温度升高,水的电离程度增大分析;
(2)在任何温度下水电离产生的H+、OH-离子浓度相等;根据硫酸电离产生的离子浓度关系计算溶液中c(H+),然后利用该温度下的水的离子积Kw计算该溶液中c(OH-);
(3)醋酸电离过程中吸热,用化学平衡移动原理分析判断;
(4)醋酸是一元弱酸,在溶液中存在电离平衡,物质的浓度c(CH3COOH)>c(HCl)=c(H+),根据溶液中含有的H+的物质的量或c(H+)变化分析。
(1)水是弱电解质,存在电离平衡,电离过程吸收热量,所以温度升高,水的电离程度增大,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),水的离子积Kw增大,α>1×10-14;
(2)H2O电离产生H+、OH-,二者浓度相等,所以在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)=c(H+)=2.4×10-7mol/L;该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,根据硫酸的电离方程式H2SO4=2H++SO42-可知该溶液中c(H+)=2c(SO42-)=2×5×10-6 mol/L=10-5mol/L,在该温度下水的离子积常数Kw= c(H+)·c(OH-)=2.4×10-7mol/L×2.4×10-7mol/L,则该溶液中c(OH-)=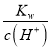 =
=![]() mol/L=5.76×10-9mol/L;
mol/L=5.76×10-9mol/L;
(3)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ ,醋酸电离吸收热量,△H>0。
CH3CH3COO﹣+H+ ,醋酸电离吸收热量,△H>0。
a.加入少量0.10mol·L﹣1的稀盐酸,使溶液中c(H+)增大,平衡逆向移动,CH3COOH电离程度减小,a不符合题意;
b.醋酸电离过程中吸收热量,加热升高温度,平衡向电离的方向移动,醋酸电离程度增大,b符合题意;
c.加水稀释至0.010mol/L,电离平衡正向移动,醋酸电离程度增大,c符合题意; d.加入少量冰醋酸,醋酸的浓度增大,电离平衡正向移动,但醋酸的电离程度降低,d不符合题意;
e.加入少量氯化钠固体,电离产生的离子对醋酸的电离平衡无影响,e不符合题意; f.加入少量0.10mol·L﹣1的NaOH溶液,OH-与醋酸电离产生的H+结合生成水,使溶液中c(H+)降低,平衡正向移动,f符合题意;
故合理选项是bcf;
(4)a.醋酸是一元弱酸,在溶液中存在电离平衡,HCl和醋酸的中c(H+)相同,则c(CH3COOH)>c(HCl),反应过程中c(H+):醋酸>HCl,所以反应所需要的时间CH3COOH<HCl,a错误;
b.反应开始反应时溶液中c(H+)相等,所以反应开始时的速率:HCl=CH3COOH,b错误;
c.由于两种溶液中溶质的物质的量n(CH3COOH)>n(HCl),所以参加反应的锌粉物质的量醋酸>盐酸,c错误;
d.溶液中CH3COOH的物质的量比盐酸中的HCl的物质的量多,所以消耗的锌粉的质量更多,d正确;
故合理选项是d。

 走进文言文系列答案
走进文言文系列答案【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
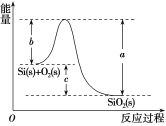
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1