题目内容
【题目】某溶液X中仅可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是
中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ![]()
![]()
A.该溶液X中可能有![]() 、
、![]()
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有![]()
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在![]() 、
、![]() 中的某一种
中的某一种
【答案】B
【解析】
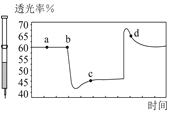
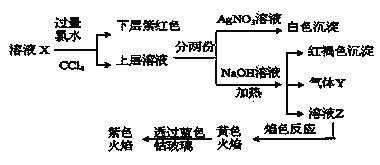
由实验流程图可知,原溶液中加入过量氯水,向反应后的溶液加入CCl4萃取,下层呈紫红色,则原溶液中含有I-,但与Fe3+不能同时存在于溶液中,即原溶液中无Fe3+;此时上层的水溶液中一定含有氯水还原生成的Cl-,所以不能确定Cl-是否存在于原溶液中;
另外一份加入NaOH产生红褐色沉淀说明溶液中存在Fe3+,那只能是Fe2+被氯水氧化生成的Fe3+,所以原溶液中含有Fe2+,Fe2+与SO32-、CO32-不共存,则原溶液中无SO32-、CO32-,同时加热产生气体Y,则Y为NH3,则原溶液中含有NH4+;溶液Z的焰色反应为黄色说明含钠离子,但开始时加入了NaOH,则不能确定原溶液中是否含Na+,透过钴玻璃观察焰色反应为紫色火焰证明一定含K+;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:![]() ,根据溶液电荷守恒可知,原溶液中一定含有SO42-和Cl-,负电荷总数
,根据溶液电荷守恒可知,原溶液中一定含有SO42-和Cl-,负电荷总数![]() ,所以溶液中没有Na+;综上原溶液中一定含有K+、Fe2+、NH4+、SO42-、I-、Cl-,一定没有Fe3+、Na+、SO32-、CO32-,据此分析解答。
,所以溶液中没有Na+;综上原溶液中一定含有K+、Fe2+、NH4+、SO42-、I-、Cl-,一定没有Fe3+、Na+、SO32-、CO32-,据此分析解答。
原溶液中加入过量氯水,向反应后的溶液加入![]() 萃取,下层呈紫红色,则原溶液中含有
萃取,下层呈紫红色,则原溶液中含有![]() ,根据共存无
,根据共存无![]() ;由于开始时加入了过量氯水,此时不能确定
;由于开始时加入了过量氯水,此时不能确定![]() 存在;另外一份加入NaOH、加热产生红褐色沉淀说明原溶液中含有被氯水氧化生成
存在;另外一份加入NaOH、加热产生红褐色沉淀说明原溶液中含有被氯水氧化生成![]() 的
的![]() ,根据共存原溶液中无
,根据共存原溶液中无![]() 、
、![]() ,同时产生气体Y,则Y为
,同时产生气体Y,则Y为![]() ,则原溶液中含有
,则原溶液中含有![]() ;由于开始时加入了NaOH,则不能确定原溶液中是否含
;由于开始时加入了NaOH,则不能确定原溶液中是否含![]() ,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含
,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含![]() ;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:
;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:![]() ,根据溶液电中性可知,原溶液中含有
,根据溶液电中性可知,原溶液中含有![]() 和
和![]() ,并且负电荷总数
,并且负电荷总数![]() ,所以溶液中没有
,所以溶液中没有![]() ,综上原溶液中一定含有
,综上原溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,一定没有
,一定没有![]() 、
、![]() 、
、![]() 、
、![]() ,
,
A、根据上述分析可知,一定没有![]() 、
、![]() ,故A错误;
,故A错误;
B、原溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,则溶质可能为硫酸亚铁、碘化钾和氯化铵,故B正确;
,则溶质可能为硫酸亚铁、碘化钾和氯化铵,故B正确;
C、如果气体Y能使湿润的红色石蕊试纸变蓝,说明溶液中一定含有![]() ,故C错误;
,故C错误;
D、因为![]() 的存在,则X中不存在
的存在,则X中不存在![]() 故D错误;
故D错误;
故选:B。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
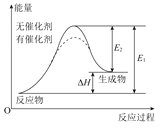
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
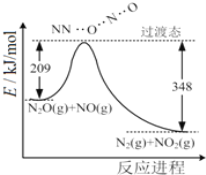
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1
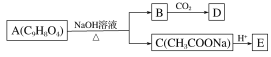
【题目】Ⅰ.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质在相应的横线上。
品名 | ××× |
配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
保质期 | 240天 |
生产日期 | 标于包装袋袋封口上 |
(1)富含蛋白质的物质是___________________________;
(2)富含糖类的物质是____________________________;
(3)富含油脂的物质是____________________________;
(4)富含维生素的物是___________________________。
Ⅱ.钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极式为:负极________________;正极_____________。