题目内容
【题目】由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象。
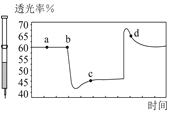
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
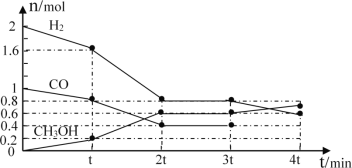
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=__。
②tmin至2tmin时速率变化的原因可能是__(要求答出所有可能原因)。
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的![]() 。请回答下列问题:
。请回答下列问题:
①SO2的转化率为__;
②达到平衡时反应放出的热量为__。
【答案】![]() 使用催化剂、升高温度 90% 35.28 kJ
使用催化剂、升高温度 90% 35.28 kJ
【解析】
Ⅰ. ① 从反应开始到tmin时,氢气的物质的量由2mol减小到1.6mol则氢气的速率为: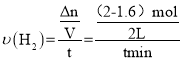 =
=![]() ,故答案为:
,故答案为:![]() 。
。
②tmin至2tmin时速率加快,升温、加压、使用催化剂均可以使反应速率加快,但因容器体积不变,所以加压不符合,可能的条件是使用了催化剂或者升高了温度,故答案为:使用催化剂、升高温度。
Ⅱ.根据题意设氧气的变化量为xmol,列出三段式。
2SO2(g) | +O2(g) | 2SO3(g) | ||
起始物质的量(mol) | 0.4 | 0.2 | ||
转化物质的量(mol) | 2x | x | 2x | |
平衡物质的量(mol) | 0.4-2x | 0.2-x | 2x |
当反应达到平衡时,容器内压强变为起始时的![]() ,由压强之比等于气体的物质的量之比,则
,由压强之比等于气体的物质的量之比,则![]() ,解得x=0.18,
,解得x=0.18,
①SO2的转化率为![]() ,故答案为:90%。
,故答案为:90%。
②由热化学方程式可知,每消耗1mol氧气,放出热量为196kJ,则平衡时消耗的氧气为0.18mol,放出热量为![]() ,故答案为:35.28 kJ。
,故答案为:35.28 kJ。

【题目】Ⅰ.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质在相应的横线上。
品名 | ××× |
配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
保质期 | 240天 |
生产日期 | 标于包装袋袋封口上 |
(1)富含蛋白质的物质是___________________________;
(2)富含糖类的物质是____________________________;
(3)富含油脂的物质是____________________________;
(4)富含维生素的物是___________________________。
Ⅱ.钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极式为:负极________________;正极_____________。
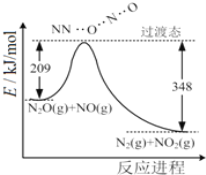
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
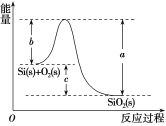
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1