题目内容
【题目】高纯氧化铁性能稳定,无毒、无臭、无味,是食品、药品、化妆品常用着色剂。 某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:
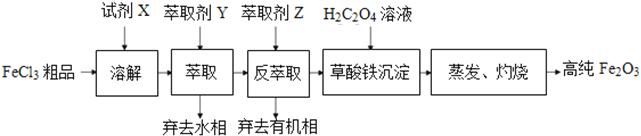
已知:试剂X是浓盐酸,HCl(浓)+FeCl3![]() HFeCl4
HFeCl4
请回答下列问题:
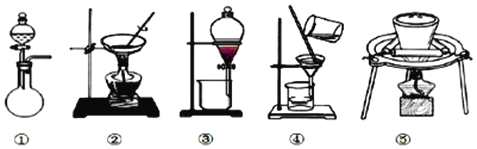
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是_________(填序号)
(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在_________ (填“水”或“有机”)相中。
②分液时,为保证液体顺利流下,应先_________,再打开旋塞,待下层液体完全流尽时,关闭悬塞后再从上口倒出上层液体。
(3)制备萃取剂Y(甲基异丁基甲酮)时,其粗产品中含有异丙叉丙酮、4-甲基-2-戊醇、酸性物质等杂质。一般可采用蒸馏法进行提纯。蒸馏时,应将温度计水银球置于_________。蒸馏前,预处理粗产品时,可以先用_________洗(填所选试剂对应的字母,下同),后用_________洗,最后用_________洗。
A水 B碳酸氢钠溶液 C乙醇
(4)下列试剂中,反萃取剂Z的最佳选择是_________,反萃取能发生的原因是_________(从化学平衡的角度进行解释)。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(5)测定产品中氧化铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标 准K2Cr2O7溶液滴定(还原产物是Cr3+,杂质不与K2Cr2O7反应)。现准确称取1.0g样品经酸溶、还原为Fe2+,用0.1000mol/L的标准溶液进行滴定。
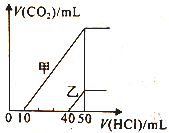
①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为_________mL。
②产品中氧化铁的含量为_________(保留三位有效数字)。
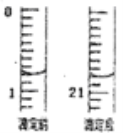
【答案】 ① 水 将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔 蒸馏烧瓶支管口处 A B A A 加高纯水时,c(HCl)降低,平衡向转化为FeCl3的方向移动 20.00 96.0%
【解析】试题分析:由题中信息及流程可知, 氯化铁粗品经浓盐酸溶解后,再用Y萃取,除去粗产品中的杂质,然后用Z对有机相进行反萃取、分液,向水相中加入草酸溶液,生成草酸铁沉淀,蒸发后,草酸铁经灼烧后分解得到高纯氧化铁。
(1)据上述实验操作过程判断,下列实验装置中,②用于蒸发;③用于萃取;④用于过滤;⑤用于灼烧;没有用到的是①。
(2)用萃取剂Y萃取的目的是除去杂质,所以①Ca、Mn、Cu等杂质离子几乎都在水相中。
②分液时,为保证液体顺利流下,应先将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,再打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体。
(3)制备萃取剂Y(甲基异丁基甲酮)时,其粗产品中含有异丙叉丙酮、4-甲基-2-戊醇、酸性物质等杂质。一般可采用蒸馏法进行提纯。蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处。蒸馏前,预处理粗产品时,可以先用水洗除去可溶于水的醇和酸等杂质,选A;后用碳酸氢钠溶液洗,除去残留的酸,选B;最后用水洗,除去残留的碳酸氢钠溶液,选A。
(4)反萃取剂Z的最佳选择是水,选A。反萃取能发生的原因是:加高纯水时,c(HCl)降低,平衡HCl(浓)+FeCl3![]() HFeCl4向转化为FeCl3的方向移动。
HFeCl4向转化为FeCl3的方向移动。
(5)①由图可知,滴定起始的读数为0.80mL,终点的读数为20.80mL,则消耗K2Cr2O7标准溶液体积为20.00mL。
②由铁元素守恒及电子转移守恒可得到关系式3Fe2O3~6Fe3+~ K2Cr2O7,则n(Fe2O3)=3n(K2Cr2O7)=3![]() 20.00
20.00![]() L
L![]() 0.1000mol/L=0.006000mol,所以产品中氧化铁的含量为0.006000mol
0.1000mol/L=0.006000mol,所以产品中氧化铁的含量为0.006000mol ![]() 160.0g/mol
160.0g/mol![]() 1.0g
1.0g![]() 100%=96.0%。
100%=96.0%。

【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数.
(b)碘值是使100g油脂加成碘的克数.
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的多,黄油比牛油的小.硬化大豆油的碘值小的原因是 .
(3)为使碘值为180的鱼油100g硬化所需要的H2的体积为升(标准状况下)?
(4)结构简式为 ![]() 的酯,若皂化值为430,求n为 .
的酯,若皂化值为430,求n为 .