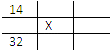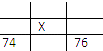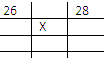题目内容
【题目】NA为阿伏加德罗常数,下列物质所含分子数最多的是
A. 0.8 mol二氧化碳
B. 标准状况下2.24L氨气
C. 3.6g水(水的摩尔质量为18g·mol-1)
D. 含NA个氢分子的氢气
【答案】D
【解析】试题分析:分子数和物质的量成正比,分子数越多,也就是物质的量越多,A为0.8 mol CO2;B为2.24L÷22.4L/mol="0.1" mol氨气;C为3.6g÷18g/mol="0.2" mol水;D为1 mol氢气;答案选D。

练习册系列答案
相关题目
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液:2Cl-+2H2O | 用惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性:H++OH-=H2O |
A. A B. B C. C D. D