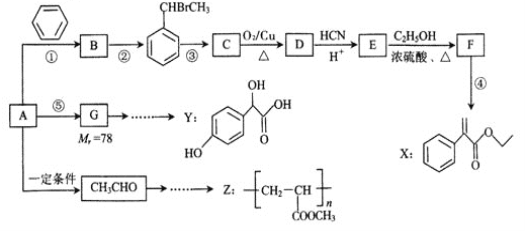
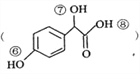
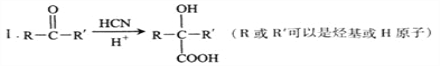题目内容
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
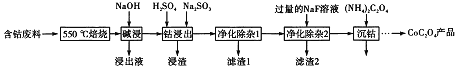
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
【答案】 除去碳和有机物 NaAlO2(NaAlO2和NaOH、Ca(OH)2也可得分) 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3(答Fe(OH)3和CaSO4与CaCO3中任意一种或两种都给分) 7.0×10-6mol/L 当滴加最后一滴酸性高锰酸钾,溶液由无色变为浅红色,且半分钟内不变色 95.55%
【解析】(1)含钴废料中含有碳及有机物,“500℃煅烧”可以除去碳和有机物,故答案为:除去碳和有机物;
(2)含钴废料中含有Co2O3,少量Fe2O3、、CaO、MgO、碳及有机物等,其中Al2O3能够溶于氢氧化钠溶于,CaO 能够与水反应,因此“浸出液”的主要成分为NaAlO2和NaOH、Ca(OH)2,故答案为:NaAlO2和NaOH、Ca(OH)2;
(3)“钴浸出”过程中,Co3+被亚硫酸钠还原为Co2+,反应的离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+,故答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,双氧水具有氧化性,能够将“钴浸出”过程中被还原生成的亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,再升温至80~85℃,加入Na2CO3溶液,调pH至5,使铁离子沉淀,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3;
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,根据Ksp(CaF2)=1.05×10-10,则c(F-)=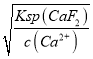 =
=![]() =
=![]() ,再根据Ksp(MgF2)=7.35×10-11,c(Mg2+)=
,再根据Ksp(MgF2)=7.35×10-11,c(Mg2+)=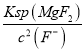 =
=![]() =7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
=7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
(6)设样品中含CoC2O4质量为x,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4-5(NH4)2C2O4-5H2C2O4-2MnO4-
147g×5 2mol
x0.1000mol/L×0.026L
![]() =
=![]() ,解得x=0.9555g,样品纯度=
,解得x=0.9555g,样品纯度=![]() ×100%=95.55%,故答案为:95.55%。
×100%=95.55%,故答案为:95.55%。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案