题目内容
【题目】某烃A是有机化学工业的基本原料。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。A可发生如图所示的一系列化学反应,其中①、②、③属于同种反应类型。请回答下列问题:
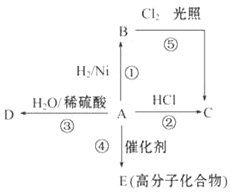
(1)写出A、B、C、D的结构简式:A____________、B___________、C__________、D_________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② ______________________________________,反应类型:__________________________。
⑤ ______________________________________,反应类型:__________________________。
【答案】 CH2=CH2 CH3-CH3 CH3CH2Cl CH3CH2OH CH2=CH2+HCl→CH3CH2Cl 加成反应 CH3-CH3+Cl2![]() CH3CH2Cl +HCl 取代反应
CH3CH2Cl +HCl 取代反应
【解析】烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,所以A为乙烯;结合流程可得:B为乙烷、C为氯乙烷、D为乙醇、E为聚乙烯。
(1)A、B、C、D的结构简式依次为:CH2=CH2、CH3-CH3、CH3CH2Cl、CH3CH2OH。
(2)反应②表示乙烯与HCl生成CH3CH2Cl,化学方程式为:CH2=CH2+HCl→CH3CH2Cl,属于加成反应;反应⑤表示乙烷与Cl2光照条件生成氯乙烷和HCl,化学方程式为:CH3-CH3+Cl2![]() CH3CH2Cl +HCl,属于取代反应。
CH3CH2Cl +HCl,属于取代反应。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】将金属钙置于空气中充分燃烧,然后向所得固体产物中加入一定量蒸馏水,观察到剧烈反应,产生大量的热,并且放出有臭味的气体。对此,化学兴趣小组的同学们在老师的指导下进行了探究。
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2,H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:________。
(3)丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是_______________;
假设3:产生臭味的气体是____________________。
【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作 | 预期现象 | 结论 |
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用________、________在短时间内快速检测产生的气体。 | __________ | 假设1成立 |
__________ | 假设2成立 | |
_________ | 假设3成立 |
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
⑴ ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
⑵ 表中2 mol·L-1氨水的质量分数为:________。
⑶ 将4 mol·L-1的氨水与2 mol·L-1的氨水等质量混合,所得氨水的物质的量浓度是_____(填序号)。
A.>3 mol·L-1 B.=3 mol·L-1 C.<3 mol·L-1 D.无法判断
⑷ 将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______(填序号)。
A.>15% B.=15% C.<15% D.无法判断
⑸ 100g浓度为4 mol·L-1的硫酸溶液与_________mL水混合,能使硫酸的物质的量浓度减小到2 mol·L-1。
