题目内容
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出元素名称:C 、D 、E 。
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,B的最简单气态氢化物的电子式为____________,BC2分子的结构式是 ______________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 。 (4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的特征电子构型是 ,在元素周期表中位置是 ,其最高价氧化物的化学式是 。
(1)氧 磷 锰 (2) σ键
σ键
(3)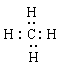 ;O=C=O SiO2 + 2OH-=SiO32- +H2O(2分)
;O=C=O SiO2 + 2OH-=SiO32- +H2O(2分)
(4)O>P>Si>Li
(5)3d54s2 第四周期 ⅦB族 Mn2O7
解析试题分析:A元素的原子最外层电子排布式为ms1,则A是第IA族元素;B元素的原子价电子排布式为ns2np2,所以B应该是第ⅣA族元素;C元素位于第二周期且原子中p能级与s能级电子总数相等,所以C是氧元素;D元素原子的M能层的p能级中有3个未成对电子,则D是P元素;E元素原子有五个未成对电子,则E的原子序数是25,属于第四周期的Mn元素。
(1)C、D、E的元素名称是氧、磷、锰。
(2)氧元素的核电荷数是8,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,其轨道表达式为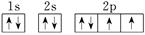 。A为非金属元素,因此A是氢元素。则按原子轨道的重叠方式,H与O形成的化合物中的共价键属于头碰头重叠,即为σ键。
。A为非金属元素,因此A是氢元素。则按原子轨道的重叠方式,H与O形成的化合物中的共价键属于头碰头重叠,即为σ键。
(3))当n=2时,B是碳元素,其最简单气态氢化物是甲烷,含有极性键的非极性分子,电子式为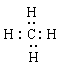 ;BC2分子是CO2,属于直线型结构,其结构式是O=C=O;当n=3时,B是Si元素。B与C形成的化合物二氧化硅与氢氧化钠溶液反应的离子方程式是SiO2 + 2OH-=SiO32- +H2O。
;BC2分子是CO2,属于直线型结构,其结构式是O=C=O;当n=3时,B是Si元素。B与C形成的化合物二氧化硅与氢氧化钠溶液反应的离子方程式是SiO2 + 2OH-=SiO32- +H2O。
(4)若A元素的原子最外层电子排布为2s1,则A是Li。B元素的原子价电子排布为3s23p2,则B是Si元素。由于非金属性越强,第一电离能越大,所以氧元素的第一电离能最大。Li是金属第一电离能最小。P的非金属性强于Si,第一电离能大于硅的,所以A、B、C、D四种元素的第一电离能由大到小的顺序是O>P>Si>Li。
(5)E元素是Mn,原子序数是25,位于周期表的第四周期第ⅦB族,所以原子的特征电子构型是3d54s2; 最高价是+7价,因此其最高价氧化物的化学式是Mn2O7。
考点:考查元素周期表的结构、元素周期律的应用、核外电子排布、电子式、轨道表达式、结构式、第一电离能比较等

Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
| A.升高温度 |
| B.加入高效催化剂 |
| C.将XQ3及时分离出去 |
| D.增大反应体系压强 |
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq)
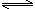 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/molCH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中 键与 键与 数目比为1:2 数目比为1:2 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (填离子符号)。
(3)H?X与H?Y两种共价键中,键的极性较强的是 ,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是 (填元素符号);Y的常见氢化物易液化的主要原因是 。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是 。
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。
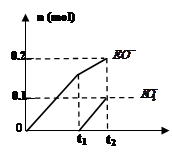
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
