题目内容
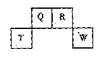
下表为元素周期表的一部分,其中编号代表对应的元素。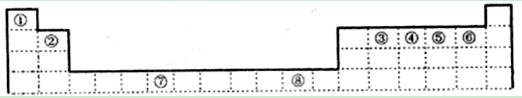
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,
(写出一种即可)其VSEPR构型为 。
(1)1s22s22p63s23p63d54s1(1分) ds (1分)
(2)sp2 sp3 (3)F > N> O>C;N2O,直线形
解析试题分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Cr,⑧为Cu,
(1)Cr的原子序数为24,则电子排布式为1s22s22p63s23p63d54s1,Cu的价电子排布为3d104s1,则位于元素周期表中的ds区,
(2)三种元素的质量比为1:6:16,原子个数比为=2:1:2,化合物对氢气的相对密度为23,相对分子质量为23×2=46,即为HCOOH,C原子采取sp2杂化方式, O原子采取sp3杂化方式,故答案为:sp2、sp3;
(3)因非金属性F>N,则第一电离能F>N,N-3的原子数为3,价电子数为3×5+1=16,而NO2+的原子数为3,价电子数为5+6×2-1=16,CO2的原子数为3,价电子数为4+6×2=16,则它们互为等电子体,结构相似来分析,已知二氧化碳为直线型,则N-3为直线型,故答案为:F;N;NO2+;直线型;
考点:本题考查物质的结构和性质,难度较大,熟悉元素的位置来推断元素,并熟悉电子排布式、杂化、氢键、配位键等知识来解答即可。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq)
 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/molCH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。
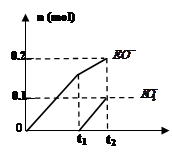
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
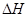 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。