题目内容
(7分) 科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。

⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
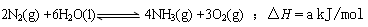
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
①合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知

则
⑴目前合成氨的技术原理为:

该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |

⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
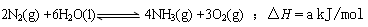
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知

则

(7分) ⑴ ①减小 ② 33.3% ③ A D(2分)
⑵ N2 + 6H+ + 6e- = 2NH3 ⑶ ①大于 ②+1530.0
⑵ N2 + 6H+ + 6e- = 2NH3 ⑶ ①大于 ②+1530.0
(1)①催化剂能降低反应的活化能,所以E2减小。
②NH3为0.1 mol,则消耗氮气是0.05mol,所以氮气的转化率是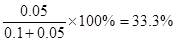 。
。
③向容器中按原比例再充入原料气,相当于增大压强,平衡向正反应方向移动,所以转化率增大,A正确。B中,物质的浓度不变,平衡不移动。C中催化剂不能影响平衡状态,D中是降低生成物浓度,平衡向正反应方向移动,所以答案选AD.
(2)阴极得到电子,所以氮气在阴极通入,方程式为N2 + 6H+ + 6e- = 2NH3。
(3)①根据表中数据可知,随着温度的升高,氨气的含量逐渐增大,说明升高温度,平衡向正反应方向移动,即正反应是吸热反应。
②考查盖斯定律的应用。根据已知反应可知,①×2-②×3即得到
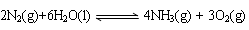 ,所以反应热是-92.4 kJ/mol×2+571.6 kJ/mol×3=+1530.0 kJ/mol。
,所以反应热是-92.4 kJ/mol×2+571.6 kJ/mol×3=+1530.0 kJ/mol。
②NH3为0.1 mol,则消耗氮气是0.05mol,所以氮气的转化率是
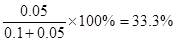 。
。③向容器中按原比例再充入原料气,相当于增大压强,平衡向正反应方向移动,所以转化率增大,A正确。B中,物质的浓度不变,平衡不移动。C中催化剂不能影响平衡状态,D中是降低生成物浓度,平衡向正反应方向移动,所以答案选AD.
(2)阴极得到电子,所以氮气在阴极通入,方程式为N2 + 6H+ + 6e- = 2NH3。
(3)①根据表中数据可知,随着温度的升高,氨气的含量逐渐增大,说明升高温度,平衡向正反应方向移动,即正反应是吸热反应。
②考查盖斯定律的应用。根据已知反应可知,①×2-②×3即得到
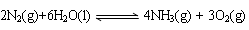 ,所以反应热是-92.4 kJ/mol×2+571.6 kJ/mol×3=+1530.0 kJ/mol。
,所以反应热是-92.4 kJ/mol×2+571.6 kJ/mol×3=+1530.0 kJ/mol。
练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目

 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。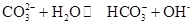 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。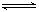 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%

 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变







 CH3OH(g)+H2O (g ).在其它
CH3OH(g)+H2O (g ).在其它 条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
