题目内容
12.下列有关说法不正确的是( )| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
分析 A、离子晶体的晶格能与离子键成正比;
B、NH3、H3O+均具有10个电子,互为等电子体;
C、邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛能够形成分子间氢键;
D、在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键.
解答 解:A、离子键与电荷成正比,与离子半径成反比,晶格能与电荷成正比,与离子半径成反比,所以离子晶体的晶格能越大离子键越强,形成的晶体越稳定,故A正确;
B、NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故B正确;
C、由于邻羟基苯甲醛形成分子内氢键,使熔沸点偏低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点偏高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故C错误;
D、氢离子和银离子提供空轨道而氧、氟、氨气提供孤电子对,所以三者之间都形成配位键,故D正确;
故选D.
点评 本题考查晶格能、等电子体、氢键和配位键的判断,明确配位键的形成是解本题关键,题目难度中等.注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对.

练习册系列答案
相关题目
3.下列反应不属于取代反应的是( )
| A. | 乙烯通入溴水中 | B. | 光照射甲烷与氯气的混合气体 | ||
| C. | 苯与液溴混合后撒入铁粉 | D. | 乙酸和乙醇在浓硫酸作用下酯化 |
7.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学概念的是( )
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用二氧化硅制备高纯硅 |
17.常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液.下列说法正确的是( )
| A. | 将①与②分别稀释相同倍数后溶液的pH:①>② | |
| B. | 若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③与④中已电离的水分子的数目相等 | |
| D. | ②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
1.用A+、B+、C-、D-四种一价离子组成四种盐AC、BD、AD、BC.在室温下其1mol•L-1的溶液,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则有关判断正确的是( )
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
| A. | A | B. | B | C. | C | D. | D |
2.下列比较正确的是( )
| A. | 电离能:N>O>F | B. | 物质熔点:H2O>I2>CO2 | ||
| C. | 共价键的极性:C-F>C-O>C-N | D. | 氢化物的稳定性:HBr>HCl>HF |
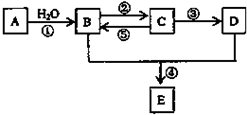 A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.
A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.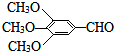 )和抗癫痫药物H(
)和抗癫痫药物H(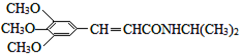 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):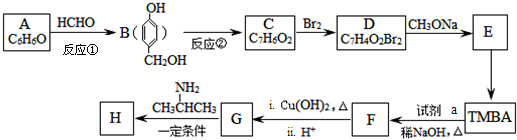
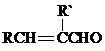 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢)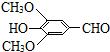 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→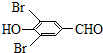 +2HBr.
+2HBr.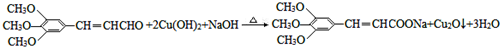 .
. )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3).
+H2NCH(CH3).