题目内容
20.铁、铜及其化合物有广泛应用.请回答下列问题:(1)FeCl3溶液可用于腐蚀电路铜板,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+,反应中的氧化剂是Fe3+
(2)某同学根据原电池原理.将上述反应设计为原电池,在该原电池中,以FeCI3溶液为电解质溶液,以石墨为正极材料.负极材料应选用铜,负极上发生氧化 反应(填写“氧化”或“还原”),电解质溶液中的Cl-向负极移动(填写“正”或“负”),当反应进行一段时间,测得某电极减轻了6.4g,则该原电池电路共转移电子的物质的量是0.2mol
(3)将铜粉加人稀硫酸中加热并不断鼓人空气,可制得硫酸铜.写出该反应的化学方程式2Cu+O2+2H2SO4$\frac{\underline{\;△\;}}{\;}$2CuSO4+2H2O.
分析 (1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液,阴离子向负极移动,电极减轻了6.4g,说明参加反应的铜为0.1mol,而1mol的铜转移2mol的电子,由此分析解答;
(3)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水.
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;Fe3+;
(2)负极材料应选用活泼的铜,负极发生氧化反应,氯离子向负极移动,电极减轻了6.4g,说明参加反应的铜为0.1mol,而1mol的铜转移2mol的电子,所以转移电子的物质的量为:0.2mol,故答案为:铜;氧化;负;0.2mol;
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4$\frac{\underline{\;△\;}}{\;}$2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;△\;}}{\;}$2CuSO4+2H2O.
点评 本题考查学生原电池的构成条件、工作原理以及燃料电池的工作原理知识,注重基础知识的考查,难度不大.

练习册系列答案
相关题目
10.下列关于有机物的说法正确的是( )
| A. | 纯净物C4H8的核磁共振氢谱峰最多为4 | |
| B. | 化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色 | |
| C. |  的同分异构体中,可以有醇、酚类物质 的同分异构体中,可以有醇、酚类物质 | |
| D. | 1 mol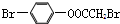 最多能与2 mol NaOH反应 最多能与2 mol NaOH反应 |
11.下列说法正确的是( )
| A. | 蛋白质、纤维、油脂、淀粉、聚乙烯都是高分子化合物 | |
| B. | 蛋白质的水解产物为氨基酸 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
15.微粒Mn-的核外电数为x,质量数为A,则M原子核内的中子数为( )
| A. | A-x+n | B. | A-x | C. | A-x-n | D. | A-N |
12.下列有关说法不正确的是( )
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
10.反应2S02(g)+O2?2SO3(g)△H<0,下列措施能提高S02转化率的是( )
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
 ;
; CH3COOH+OH-;
CH3COOH+OH-;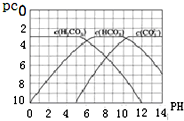 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.