题目内容
17.常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液.下列说法正确的是( )| A. | 将①与②分别稀释相同倍数后溶液的pH:①>② | |
| B. | 若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③与④中已电离的水分子的数目相等 | |
| D. | ②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
分析 A、醋酸为弱酸,部分电离;
B、若②与③混合后溶液呈中性,说明同浓度的醋酸和氨水的电离程度相同;
C、氨水抑制水电离,醋酸钠促进水电离;
D、CH3COOH和CH3COONa溶液混合液中醋酸的电离程度大于醋酸根的水解程度,溶液显酸性.
解答 解:A、体积、物质的量浓度均相等的盐酸和醋酸,稀释相同倍数后,溶液的浓度仍然相同,由于醋酸为弱酸,部分电离,所以醋酸中氢离子的浓度小,则pH大,即pH:①<②,故A错误;
B、若②与③混合后溶液呈中性,说明同浓度的醋酸和氨水的电离程度相同,所以常温下Ka(CH3COOH)=Kb(NH3•H2O),故B正确;
C、氨水抑制水电离,醋酸钠促进水电离,所以体积、物质的量浓度均相等的氨水和醋酸钠中,醋酸钠中水电离程度大,所以电离的水分子的数目多,故C错误;
D、CH3COOH和CH3COONa溶液混合液中醋酸的电离程度大于醋酸根的水解程度,则c(CH3COO-)>c(CH3COOH),溶液显酸性则c(H+)>c(OH-),但是不能得出c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+),故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡移动,盐类水解,离子浓度的比较,质子守恒的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列关于苯的叙述正确的是( )
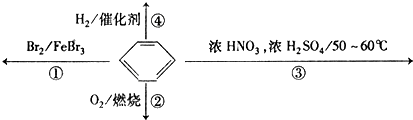

| A. | 反应①为取代反应,有机产物的密度比水小 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键 |
12.下列有关说法不正确的是( )
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
6.汽车尾气中NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体中的血管内又有传送信息的功能,下列有关NO的说法正确的是( )
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
 ;
; CH3COOH+OH-;
CH3COOH+OH-; 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
; pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.