题目内容
已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m
B
解析试题分析:同一周期元素,原子半径随着原子序数的增大而减小;同一主族元素,原子半径随着原子序数的增大而增大,则N、P是同一主族元素,P元素的原子序数大于N元素的原子序数,所以P的原子半径大于N的原子半径,Si、P、S是同一周期的元素,且p的原子序数大于Si的原子序数小于S的原子序数,所以P的原子半径小于Si的原子半径大于S的原子半径,则磷元素的原子半径可能为1.10×10-10m,故选B。
考点:考查微粒半径大小的比较

练习册系列答案
相关题目
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0 ℃ | 57.6 ℃ | -84.7 ℃ |
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
下列关于F、Cl、Br、I的比较,说法正确的是
| A.原子最外层的电子数随核电荷数的增加而增多 |
| B.简单阴离子的还原性随核电荷数的增加而增强 |
| C.氢化物的稳定性随核电荷数的增加而增强 |
| D.非金属性随核电荷数的增加而增强 |
短周期元素X?Y?Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13?下列判断正确的是
| A.Y元素位于第2周期 | B.Y?Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ>HnX |
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,
Y+和Z-离子具有相同的电子层结构。下列说法不正确的是( )
| A.原子最外层电子数:Z>X>Y | B.氢化物的稳定性:Z>X |
| C.离子半径:X2->Y+>Z- | D.原子序数:X>Y>Z |
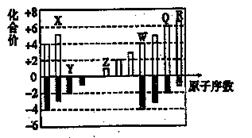
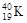 、
、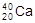 D.H、D、T
D.H、D、T