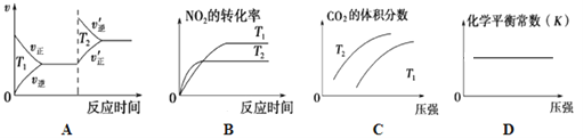
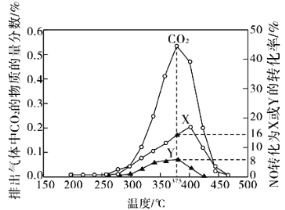
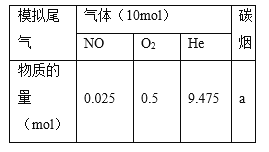
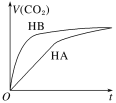
题目内容
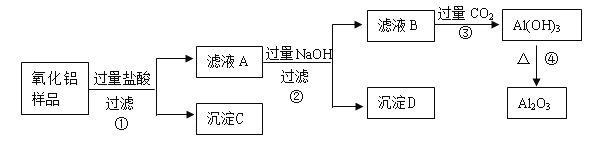
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
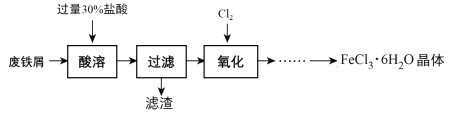
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1) “酸溶”过程中发生主要反应有:
①Fe + 2H+= Fe2++ H2↑;②Fe2O3+ 6 H+= 2Fe3++ 3H2O;③__________________。(用离子方程式)
(2) “酸溶”需控制温度在40℃左右,最佳的加热方式是____________。
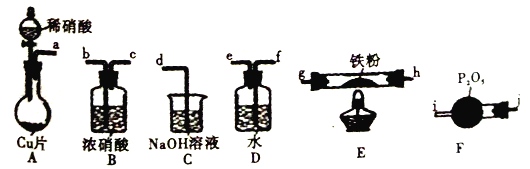
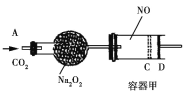
(3) “氧化”过程可在下图所示装置中进行。
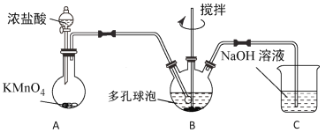
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为______________________。
②装置C的作用是__________________________________________________。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是_____________________________________________________________________。
④证明装置B溶液中Fe2+已完全________________________________________________________________。
【答案】2Fe3++Fe=3Fe2+ 在40℃水浴中加热 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8 H2O 吸收Cl2,防止污染空气 减慢分液漏斗中浓盐酸的滴加速度(或增加B中溶质的浓度) 取B中溶液于试管中,滴加少量Fe3[Fe(CN)6]2溶液,若无蓝色沉淀生成,则证明亚铁离子已被完全氧化
【解析】
根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,氯得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收。
(1)因为氧化性的强弱:Fe3+>H+>Fe2+书写离子反应方程式为:Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(2)“酸浸”时需控制温度为40℃左右,可以采用的加热方式是40℃水浴加热,故答案为:40℃水浴加热;
(3)①KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
②氯气有毒,应该用碱液吸收,防止污染环境,故答案为:吸收多余的氯气,防止污染环境;
③为提高Cl2的吸收效率,可减慢分液漏斗中浓盐酸的滴加速度控制Cl2的流速、可适当升高B中溶液温度、增大B中混合溶液的浓度、加快搅拌等等措施,故答案为:减慢分液漏斗中浓盐酸的滴加速度(或增加B中溶质的浓度);
④Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故答案为:取B中少量溶液,滴加K3[Fe(CN)6]溶液,如果无蓝色沉淀生成,则说明Fe2+已完全被氧化成Fe3+的,反之则没有。