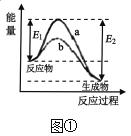
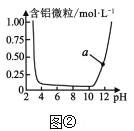
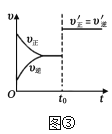
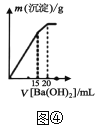
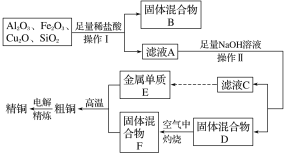
题目内容
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
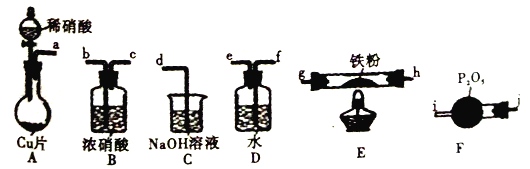
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
【答案】D
【解析】
A、根据实验原理利用NO被灼热的铁粉还原为N2,同时生成FeO,所以首先应制备纯净的干燥的NO,利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸和水蒸气气体,则先通过装置D除去挥发出的HNO3等酸性气体,然后再通过F干燥,得到纯净的干燥的NO进入E中与铁粉反应,最后处理多余的NO,又因为NaOH溶液不与NO反应,而浓硝酸可氧化NO生成NO2,所以最终先通过B氧化NO,后再通过C吸收,故上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d,正确;B、装置E中NO被灼热的铁粉还原为N2,同时生成FeO,反应的化学方程式为2NO+2Fe![]() 2FeO+N2,正确;C、装置D盛放的是水,其作用是除去挥发出的HNO3等酸性气体,正确;D、装置B盛放的是浓硝酸,依题意可以氧化NO,便于氢氧化钠溶液吸收,错误。
2FeO+N2,正确;C、装置D盛放的是水,其作用是除去挥发出的HNO3等酸性气体,正确;D、装置B盛放的是浓硝酸,依题意可以氧化NO,便于氢氧化钠溶液吸收,错误。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某化学兴趣小组用中和滴定法测定一瓶烧碱溶液的浓度(该烧碱溶液中不含与酸反应的杂质),测定过程如下:
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.45 | 24.40 |
2 | 20.00 | 2.20 | 26.25 |
3 | 20.00 | 0.10 | 17.10 |
(1)上述实验操作的正确顺序是___(填字母序号)。
(2)实验中,除用酚酞作指示剂外,还可以选用___作该实验的指示剂,在锥形瓶下垫一张白纸的作用是___。
(3)如何判断滴定达到了终点?___
(4)根据实验数据,计算待测碱液的浓度为___mol·L-1(保留两位小数)。
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是___。(填正确答案标号)
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数